Co po co Geologowi wiedza o strukturze elektronowej atomu?
1. Elektronowa struktura atomu
1.4. Podpowłoki elektronowe i konfiguracja podpowłokowa
Ze względu na fakt, iż elektrony tworzące powłokę mają energię zbliżoną, ale nie taką samą, można je w obrębie powłoki podzielić na mniejsze zespoły o równej energii, nazywane podpowłokami elektronowymi.
Podpowłoki podobnie jak powłoki mają swoje oznaczenia literowe s, p, d, f (dalej g, h, …), a należące do nich elektrony nazywa się odpowiednio elektronami s, p itd. Charakteryzuje je również ograniczona i stała pojemność: podpowłoka s może zawierać najwyżej 2 elektrony, a każda następna podpowłoka (p, d, f…) ma pojemność o 4 elektrony większą od poprzedniczki, stad p – 6, d – 10, f – 14 elektronów.
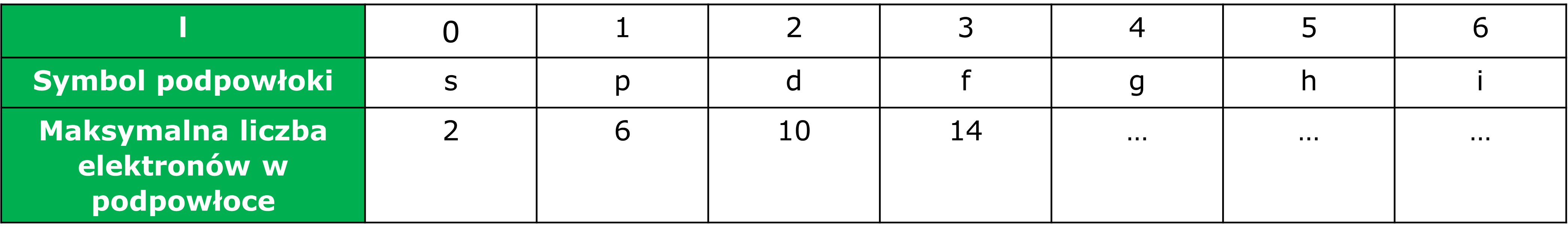
Wraz ze wzrostem numeru powłoki wzrasta liczba możliwych podpowłok i jest ona równa numerowi powłoki, zatem powłoka pierwsza posiada tylko jedną podpowłokę (1s), co wskazuję, że praktycznie powłoka ta nie dzieli się na podpowłoki, powłoka druga ma dwie podpowłoki (2s i 2p), trzecia – trzy (3s, 3p i 3d), a czwarta - cztery (4s, 4p, 4d, 4f), itd.
W obrębie danej powłoki energia elektronów zawsze wzrasta w kolejności s, p, d, f, …, wskazując na schemat zapełniania podpowłok. Również w tej samej kolejności wzrasta odległość między jądrem, a warstwą kulistą, w której elektrony danej podpowłoki przebywają najczęściej, natomiast maleje siła oddziaływania jądra i otaczających go elektronów.
Konfiguracja podpowłokowa to takie rozmieszczenie elektronów w powłokach i
podpowłokach, które zapewnia możliwie najniższą energię każdemu z nich
Umowny zapis podpowłokowej konfiguracji elektronowej zawiera ciąg symboli typu nak, gdzie n – numer powłoki (1-7), a – symbol podpowłoki (s, p, d, f, …), k – liczba elektronów w podpowłoce
Przykład:
20Ca: 1s22s22p63s23p64s2
|
Powłokowa konfiguracja elektronowa 20Ca |
K2 |
L8 |
M8 |
N2 |
|
Podpowłokowa konfiguracja elektronowa 20Ca |
1s2 |
2s22p6 |
3s23p6 |
4s2 |
Na podstawie zamieszczonego przykładu widać, iż część elektronów znajduje się w powłoce wyższej (czwartej), mimo iż nie została w pełni wykorzystana powłoka niższa (trzecia). Oznacza to że w podpowłoce 4s elektrony mają niższą energię niż miałyby w przypadku zajęcia podpowłoki 3d.
Konfiguracja podpowłokową można ustalić na podstawie znanej konfiguracji powłokowej, co zostało przedstawione w poniższym przykładzie:
55Cs: K2L8M18N18O8P1 → 55Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1
Konfiguracja podpowłokową można również zapisać w postaci skróconej, z
wykorzystaniem ujętego w nawias kwadratowy symbolu helowca poprzedzającego dany
pierwiastek w układzie okresowym, oraz członów typu nak dla elektronów, które należy dodać do
tego helowca, aby uzyskać konfigurację atomu danego pierwiastka
Przykład:
55Cs: 1s22s22p63s23p64s23d104p65s24d105p66s1
55Cs: [Xe]6s1

