Co po co Geologowi wiedza o strukturze elektronowej atomu?
1. Elektronowa struktura atomu
1.5. Stany orbitalne i konfiguracja orbitalna
Elektrony danej podpowłoki ze względu na swoje zróżnicowanie pod względem posiadanych właściwości magnetycznych tworzą podzbiory zwane stanami orbitalnymi (poziomami orbitalnymi).
Wielkością fizyczną charakteryzującą pole magnetyczne wytworzone przez elektron jest spin. Spin elektronu ma jedną wartość i stanowi cechę charakterystyczną cząstki, dwa elektrony mogą się natomiast różnić orientacją spinu. Elektrony o przeciwnie zorientowanych spinach przyciągają się wzajemnie, a o jednakowej orientacji spinu – odpychają. Stąd każdy stan orbitalny może być zajęty najwyżej przez dwa elektrony różniące się orientacją spinu, przez co liczba stanów orbitalnych w podpowłoce jest równa połowie maksymalnej liczby elektronów jaką może być obsadzona podpowłoka.
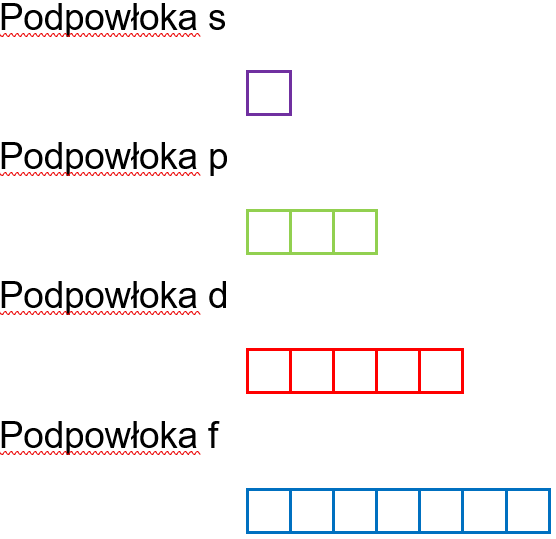
Konfiguracja orbitalna to rozmieszczenie elektronów w stanach orbitalnych. Przedstawia się ją za pomocą umownych znaków graficznych. Liczba stanów orbitalnych dla poszczególnych podpowłok przedstawia się następująco: s – 1 stan orbitalny, p – 3 stany orbitalne, d – 5 stanów orbitalnych, f – 7 stanów orbitalnych, i jest ona charakterystyczna dla danej podpowłoki bez względu na numer powłoki do której należy.
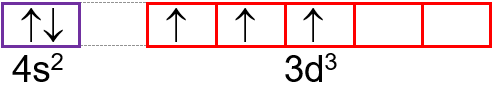
W zapisie konfiguracji orbitalnej elektron zaznaczany jest pojedynczą strzałką, skierowaną w górę (↑) lub w dół (↓), symbolizującą elektron zajmujący dany stan. Przy czym przeciwne zwroty strzałek (↑↓) oznaczają różne orientacje spinu, zgodne zwroty (↑↑) lub (↓↓) – takie same orientacje. Dwa elektrony zajmujące ten sam stan orbitalny, a więc elektrony o takiej samej energii, a różniące się jedynie orientacją spinu są nazywane elektronami sparowanymi. W przypadku gdy dany stan orbitalny zajmuje tylko jeden elektron to jest on nazywany elektronem niesparowanym.
Rozmieszczenie elektronów w stanach orbitalnych danej podpowłoki określa reguła Hunda według której, liczba niesparowanych elektronów w danej podpowłoce powinna być możliwie największa, a pary elektronów (↑↓) tworzą się dopiero po zapełnieniu wszystkich stanów orbitalnych danej podpowłoki przez elektrony niesparowane, natomiast elektrony zajmujące pojedynczo stany orbitalne w tej samej podpowłoce to elektrony o spinach równoległych (czyli elektrony o jednakowej orientacji spinu).
Przykład:
20Ca: 1s22s22p63s23p64s2

W praktyce zapis graficzny ogranicza się do tych podpowłok, które zapełnione są częściowo, a dla pozostałych należy podać konfiguracje podpowłokową.
Przykład:
23V: 1s22s22p63s23p64s23d3

23V: 1s22s22p63s23p6