Układ okresowy pierwiastków chemicznych i prawo okresowości
Wymagania zaliczenia
3. Prawo okresowości i okresowość fizycznych i chemicznych właściwości pierwiastków
3.3. Promień jonowy
- Odległość najbardziej oddalonych elektronów od jądra atomu w przypadku jonów utworzonych z jednego atomu lub też od geometrycznego centrum jonów złożonych z większej liczby atomów.
- Promienie jonowe wyznacza się na podstawie badań rentgenostrukturalnych uśredniając długości wiązań jonowych, jakie tworzy dany jon z różnymi przeciw jonami.
- W przypadku jonów prostych, dla anionów, ich promienie jonowe są większe od promieni tworzących ich atomów, zaś w przypadku kationów jest odwrotnie. Czym większy ładunek ujemny posiada dany anion, tym jego promień jest większy; a czym większy ładunek dodatni ma kation, tym jego promień jest mniejszy.
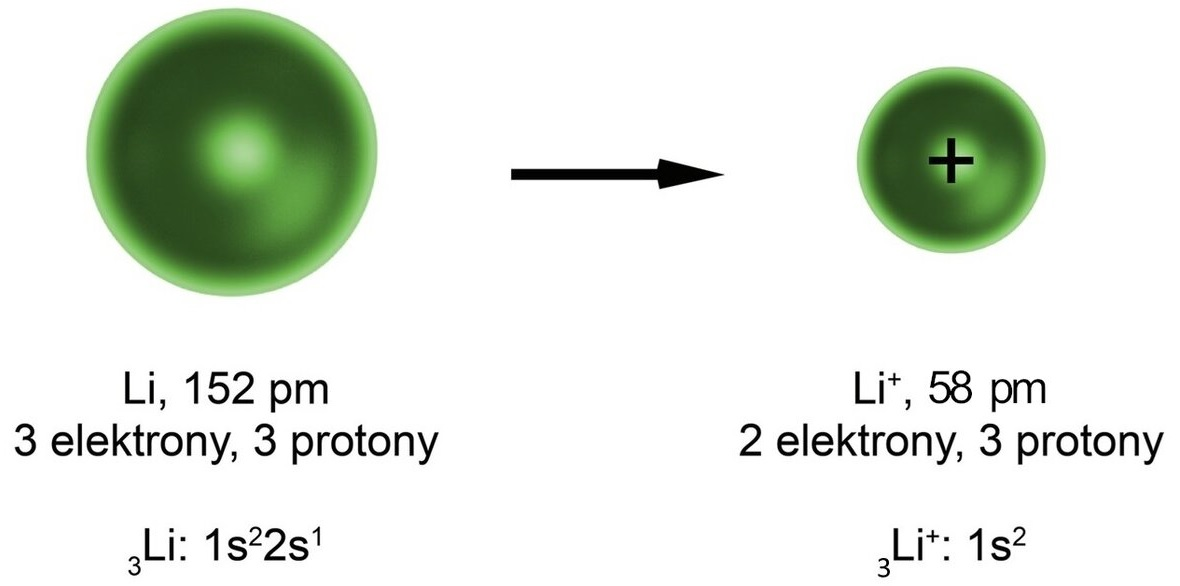
Grafika: Atom litu traci elektron, dlatego promień kationu litu jest mniejszy od promienia atomu litu*.
Źródło: GroMar Sp. z o.o., licencja CC BY-SA 3.0.
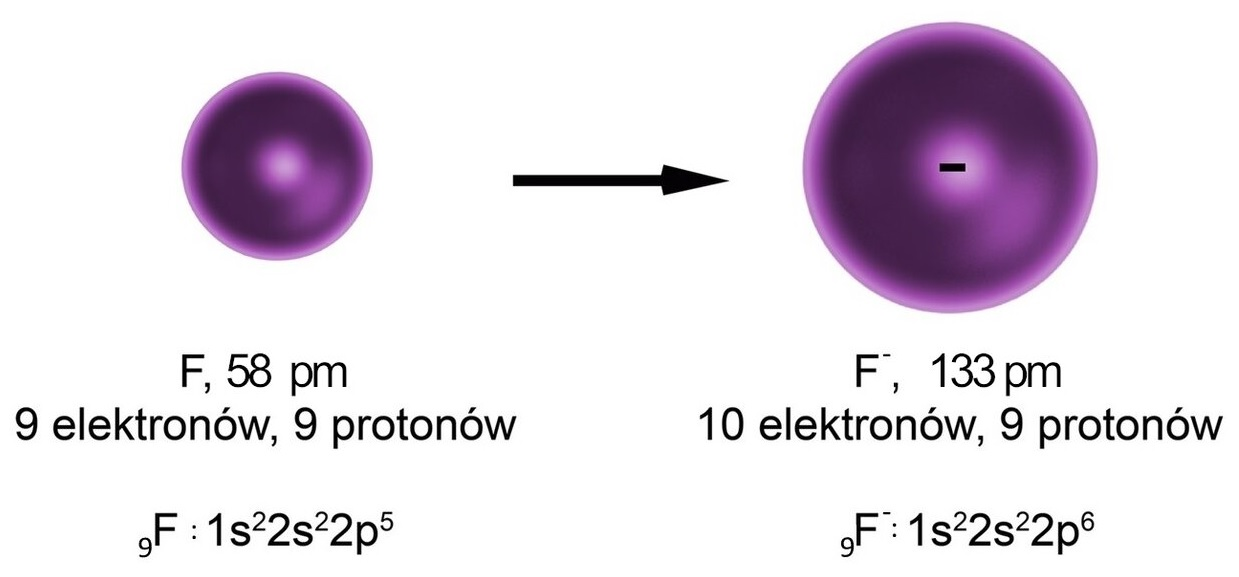
Grafika: Atom fluoru zyskuje elektron, dlatego promień anionu fluorkowego jest większy od promienia atomu fluoru*. Źródło: GroMar Sp. z o.o., licencja CC BY-SA 3.0.
- Oderwanie jednego lub więcej elektronów z atomu (czyli utworzenie kationu) musi skutkować zmniejszeniem się promienia chmury elektronowej r, zaś przyłączenie jednego lub więcej elektronów wymusza zwiększenie tego promienia.
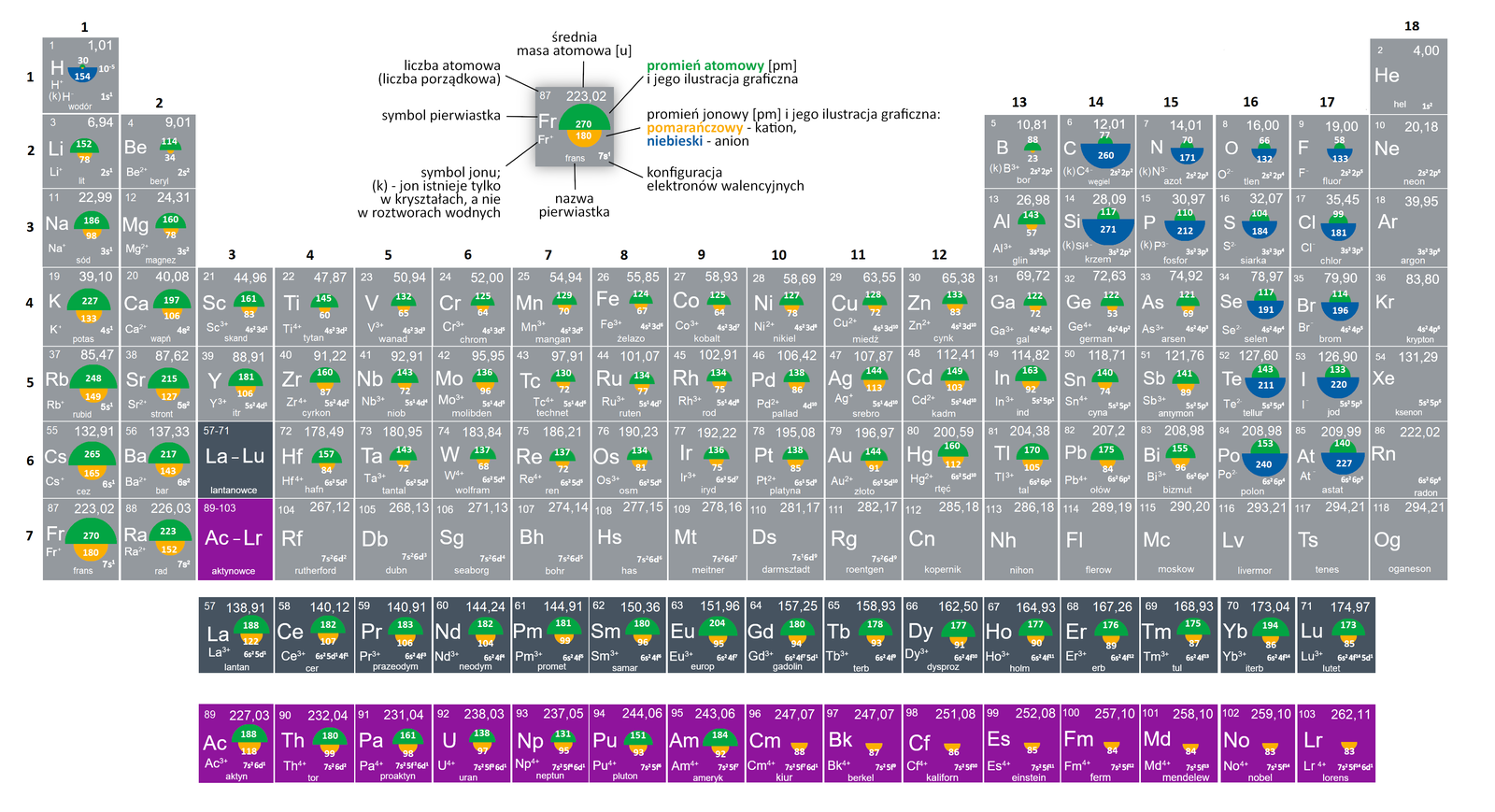
Grafika: Wartości promieni atomowych i jonowych pierwiastków*.
Źródło: GroMar Sp. z o.o., na podstawie K. Pazdro, A. Rola–Noworyta,
Chemia Repetytorium dla przyszłych maturzystów i studentów, Oficyna Edukacyjna Krzysztof Pazdro, Warszawa 2014,
licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot