Układ okresowy pierwiastków chemicznych i prawo okresowości
Wymagania zaliczenia
3. Prawo okresowości i okresowość fizycznych i chemicznych właściwości pierwiastków
3.5. Powinowactwo elektronowe
- Wielkość charakteryzująca zdolność atomu (lub cząsteczki) w stanie podstawowym do przyłączania elektronu i tworzenia jonu ujemnego (anionu).
- Ilościowo określa się ją jako energię, która wydziela się w wyniku tego procesu. Tradycyjnie energię tę podaje się w elektronowoltach (eV).
- Powinowactwo elektronowe jest pośrednią miarą elektroujemności pierwiastków chemicznych. Im większa wartość powinowactwa, tym większa elektroujemność pierwiastka.
- Powinowactwo elektronowe pierwiastków grup głównych staje się mniej ujemne z przejściem w dół grupy. Atomy o największym promieniu, które mają najniższe energie jonizacji (powinowactwo do własnych elektronów walencyjnych), mają też najniższe powinowactwo dla dodawanych elektronów.
- Istnieją jednak dwa główne wyjątki od tej tendencji:
- Wartości
powinowactwa elektronów pierwiastków B do F w drugim okresie są mniej ujemne
niż w przypadku elementów znajdujących się bezpośrednio pod nimi w trzecim
okresie. Pierwiastki okresu trzeciego (n = 3) mają najniższe wartości
powinowactwa elektronowego.
- Wartości
powinowactwa elektronowego metali ziem alkalicznych są bardziej ujemne dla pierwiastków od Be do Ba. Tworzenie się anionów
pierwiastków cięższych jest energetycznie korzystniejsze.
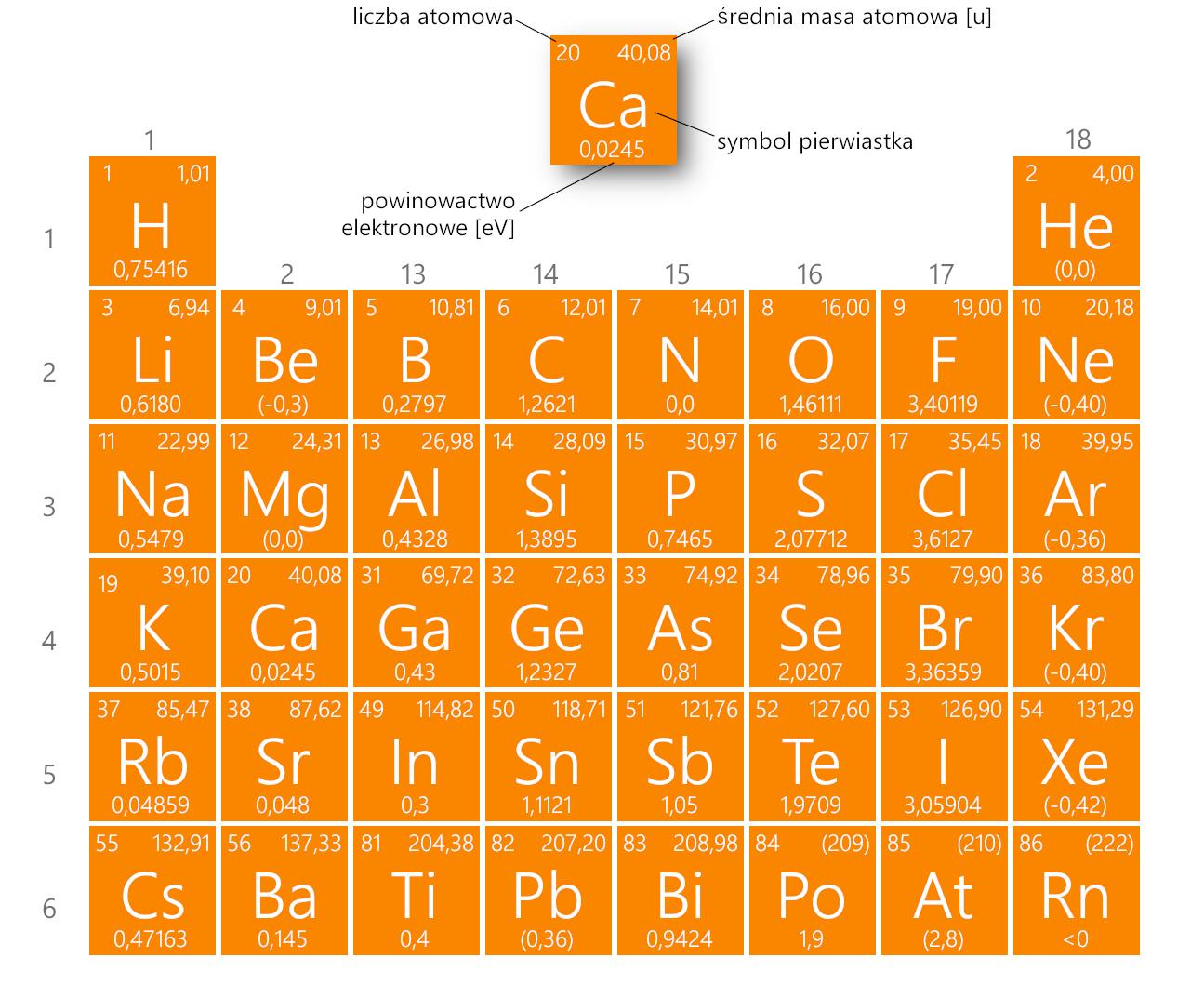
Grafika: Powinowactwo elektronowe pierwiastków grup głównych [eV]*. Źródło: GroMar Sp. z o.o., na podstawie Mizerski W., Tablice Chemiczne, Adamantan, 2004, licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot
