Układ okresowy pierwiastków chemicznych i prawo okresowości
Wymagania zaliczenia
3. Prawo okresowości i okresowość fizycznych i chemicznych właściwości pierwiastków
3.4. Elektroujemność
- Zdolność atomu wchodzącego w skład cząsteczki do przyciągania ku sobie elektronów.
- Ma znaczenie jedynie jakościowe.
- Elektroujemność pierwiastków jest często zależna od układu atomów w danym związku, ich stopnia utlenienia, przyjętej w danym momencie hybrydyzacji i dość często zdarza się, że wiązania polaryzują się odwrotnie niżby to wynikało z formalnej elektroujemności związanych pierwiastków.
- Zaproponowano wiele sposobów, aby ilościowo zdefiniować ogólną elektroujemność pierwiastków, np.
- Skala Paulinga,
- Skala Allreda-Rochowa,
- Skala Mullikena.
Aby dowiedzieć się więcej, obejrzyj film Elektroujemność w ujęciu teoretycznym i praktycznym.
Film: Elektroujemność w ujęciu teoretycznym i praktycznym*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Skala Paulinga
- Jest oparta na pomiarach energii i polaryzacji wiązań prostych dwuatomowych związków chemicznych.
- Jest skalą empiryczną opartą na doświadczalnych wielkościach termodynamicznych. Miarą różnicy elektroujemności pierwiastków A i B na skali Paulinga jest różnica energii wiązania heterojądrowego A-B i średniej energii homojądrowych wiązań A-A i B-B.
- Zgodnie z tą skalą największą elektroujemność ma fluor (E = 4), najmniejszą – cez i frans (E = 0,7), pozostałe pierwiastki są umieszczone pomiędzy.
- Elektroujemność wg Paulinga jest zależna od liczby elektronów występujących w atomach danego pierwiastka i kwadratu jego promienia walencyjnego.
- Duża elektroujemność jest cechą charakterystyczną niemetali – pierwiastków zgrupowanych w prawym górnym trójkącie układu okresowego. Metale mają małą elektroujemność i w tym przypadku charakteryzuje ona zdolność atomu do oddawania elektronów.
- Wzrasta w okresach od strony lewej ku prawej.
- Maleje w grupach układu okresowego ze wzrostem liczby atomowej.
- W grupach głównych i pobocznych elektroujemność zmniejsza się przy przejściu od pierwiastków lżejszych do cięższych.
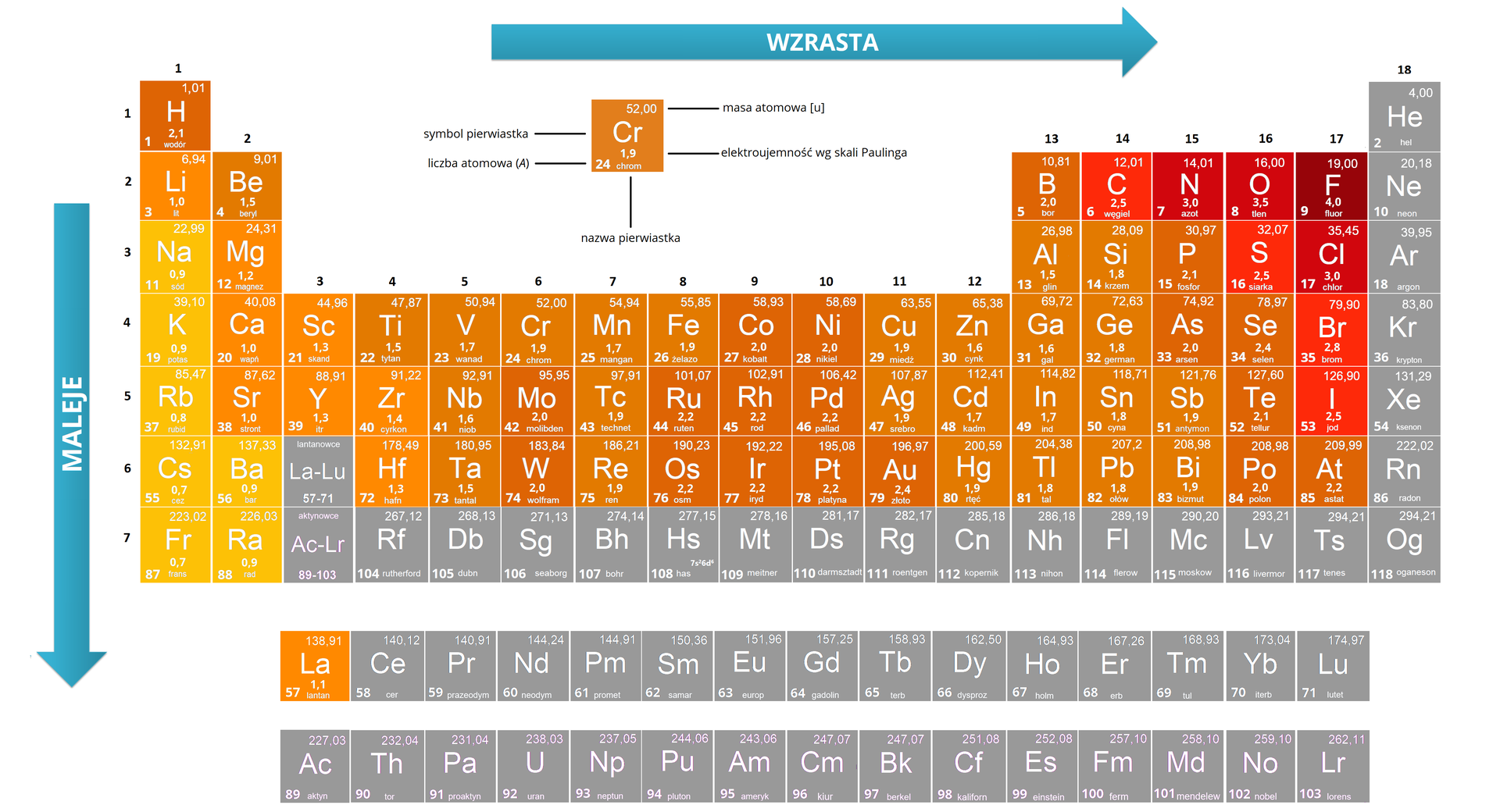
Grafika: Elektroujemność na tle układu pierwiastków*.
Źródło: GroMar Sp. z o.o., na podstawie W. Mizerski, Tablice chemiczne, Warszawa 2004.,
licencja CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot

