Wiązania chemiczne
2. Wzory elektronowe
 Obejrzyj film pt. Tworzenie wzorów jonów złożonych.
Obejrzyj film pt. Tworzenie wzorów jonów złożonych.
Mechanizm tworzenia wiązań chemicznych, można przedstawić z użyciem wzorów elektronowych Lewisa. Są to wzory strukturalne z zaznaczonym rozmieszczeniem par elektronowych wiążących (elektrony wspólne) i niewiążących (wolne pary elektronowe)
Wyróżnić można trzy rodzaje wzorów elektronowych:
- kropkowe (każdy pojedynczy elektron przedstawiany jest za pomocą kropki),
- kreskowo–kropkowe (wiążąca para elektronowa przedstawiona jest kreską, a wolna para elektronowa zaznaczona jest jako dwie kropki),
- kreskowe (każda para elektronów przedstawiana jest za pomocą kreski).
Poniżej przedstawiono sposób tworzenia wzorów elektronowych na przykładzie cząsteczki fluorowodoru:
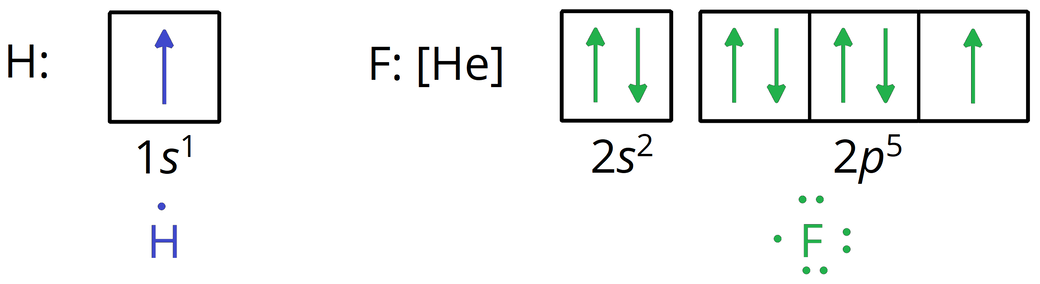
- wzór elektronowy kropkowy
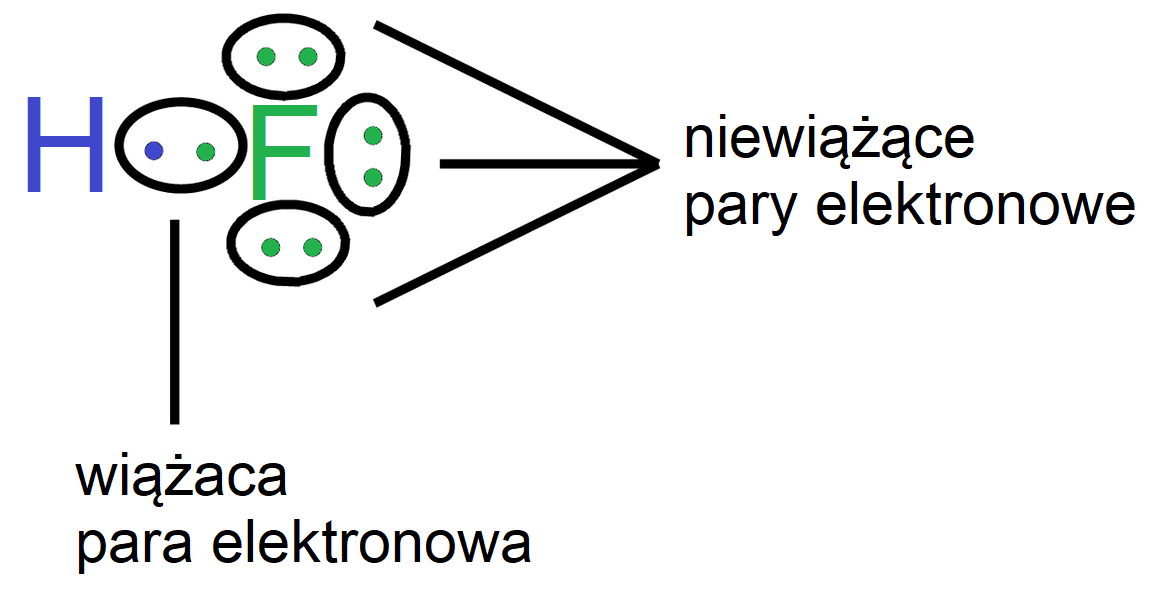
- wzór elektronowy kreskowo–kropkowy
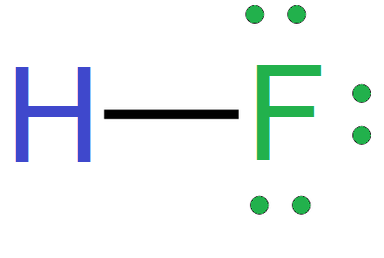
- wzór elektronowy kreskowy
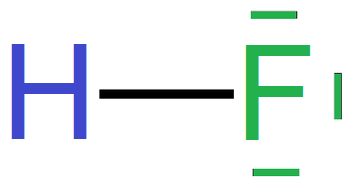
W przypadku natomiast wiązań koordynacyjnych gdzie para elektronowa pochodzi od jednego atomu tworzącego wiązanie – donora, i jest przesunięta w kierunku drugiego atomu – akceptora, wiązanie to można zaznaczyć we wzorach kreskowych i kreskowo‑kropkowych strzałką skierowaną w stronę akceptora.Grafiki: Tworzenie wzoru elektronowego cząsteczki fluorowodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Poniżej przedstawiono sposób tworzenia wzorów elektronowych na przykładzie cząsteczki fluorowodoru:
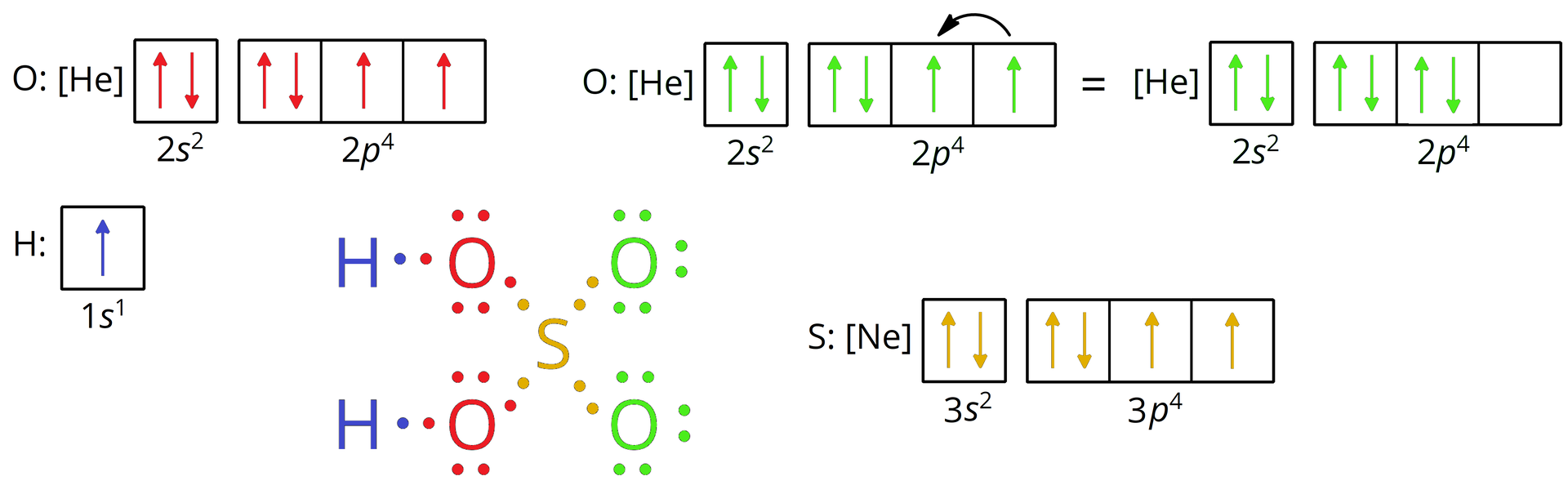
- wzór elektronowy kropkowy
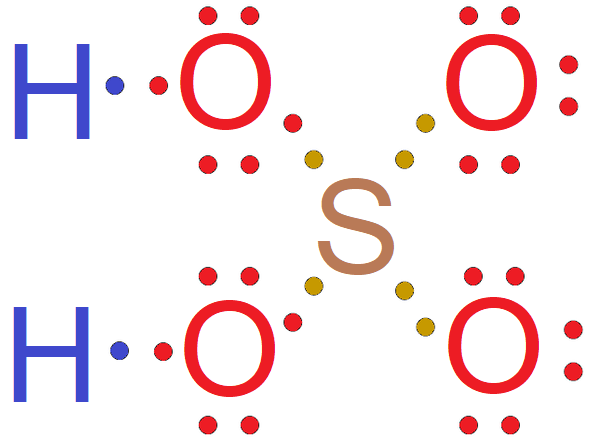
- wzór elektronowy kreskowo–kropkowy

- wzór elektronowy kreskowy
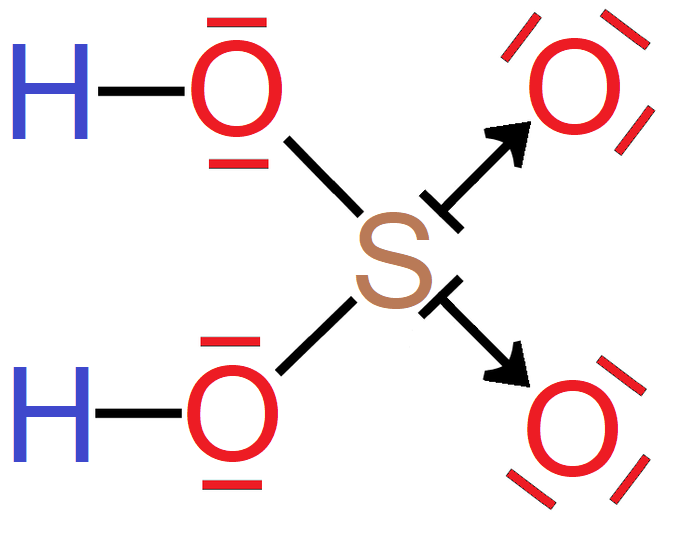
Grafiki: Tworzenie wzoru elektronowego cząsteczki fluorowodoru*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

