Wiązania chemiczne
Wymagania zaliczenia
8. Wiązanie wodorowe
 Nurtuje Cię pytanie dotyczące wiązania wodorowego*? Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie dotyczące wiązania wodorowego*? Obejrzyj film, może uzyskasz odpowiedź.
Film: Wiązania wodorowe*. Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
Wiązanie wodorowe
- oddziaływanie donor – akceptor, w które zaangażowany jest atom wodoru D–H···A,
- słabe oddziaływanie elektrostatyczne (linia przerywana) między atomem wodoru, związanym kowalencyjnie (linia ciągła) z atomem o dużej elektroujemności (D) i wolną parą elektronową atomu silnie elektroujemnego (A) np. fluoru, tlenu, chloru, azotu, należącego do innej drobiny,
- ma charakter kierunkowy, jądra atomów D–H···A leżą najczęściej wzdłuż linii prostej,
- energia uwalniana podczas tworzenia wiązania wodorowego jest zwykle o rząd wielkości niższa od energii uwalnianej podczas tworzenia typowych wiązań kowalencyjnych,
- określane jako słabe wiązanie, jednak jest niezwykle ważnym elementem struktury wielu substancji, w znacznym stopniu warunkującym ich właściwości,
- liczba wiązań wodorowych tworzonych przez atom donora (D) nie może być większa od liczby wolnych par elektronowych tego atomu.
Warunki konieczne istnienia wiązania wodorowego:
- duże wartości elektroujemności D i A,
- istnienie w akceptorze wolnej pary elektronowej lub polaryzowalnych π - elektronów.
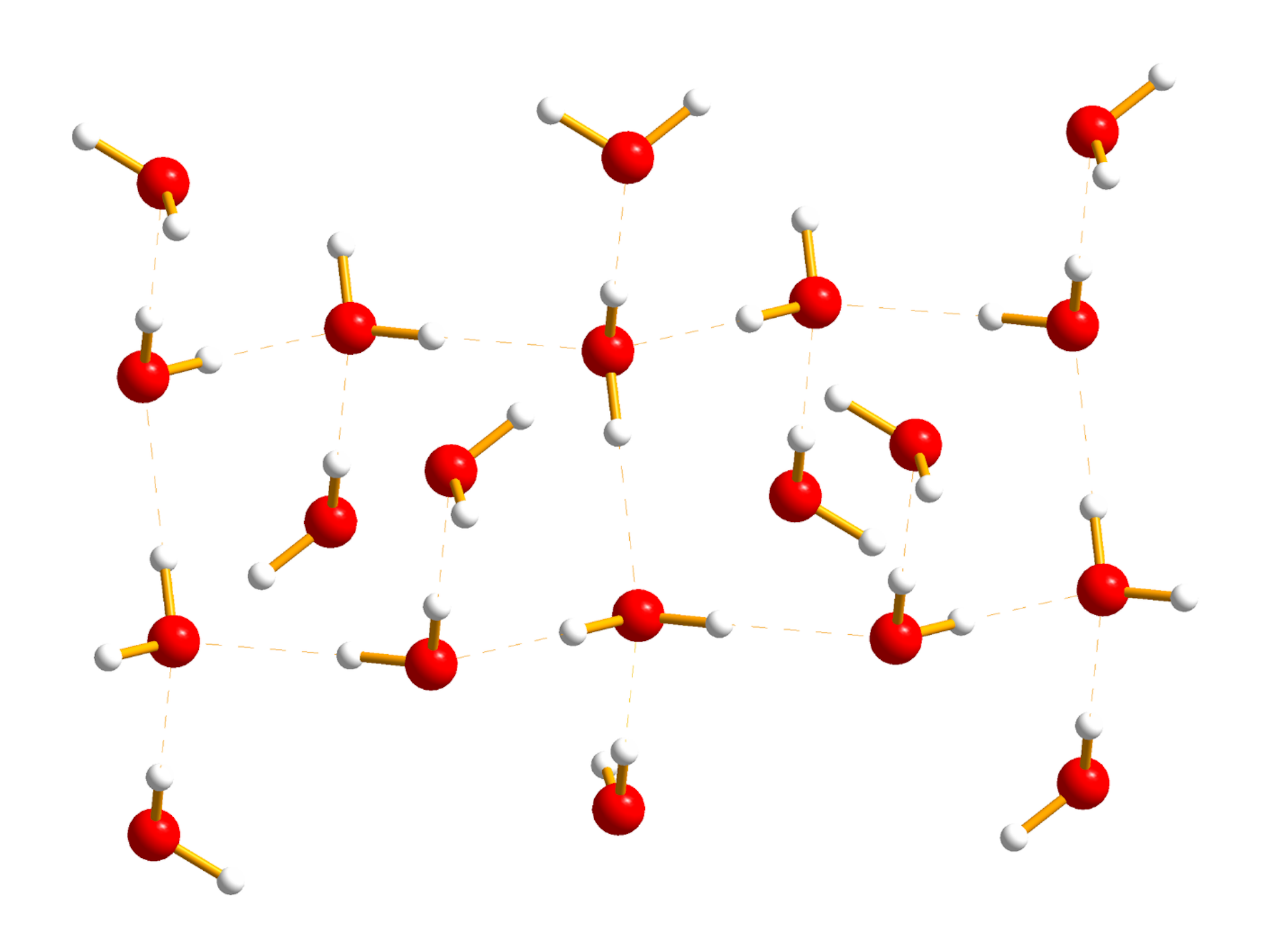
Grafika: Sieć wiązań wodorowych między cząsteczkami wody*.
Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
 Zastanawiałeś się kiedyś Dlaczego woda wykazuje niezwykłe właściwości?* Obejrzyj film, może uzyskasz odpowiedź.
Zastanawiałeś się kiedyś Dlaczego woda wykazuje niezwykłe właściwości?* Obejrzyj film, może uzyskasz odpowiedź.
Film: Dlaczego woda wykazuje niezwykłe właściwości?*. Źródło: GroMar Sp. z o.o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

