Wiązania chemiczne
4. Wiązania kowalencyjne
4.2. Wiązanie kowalencyjne spolaryzowane
Wiązanie kowalencyjne spolaryzowane – atomy połączone wspólną parą elektronową przyciągają ją w różnym stopniu, co powoduje niesymetryczne rozmieszczenie ładunku elektrycznego w cząsteczce. Wspólna para jest przyciągana przez atom bardziej elektroujemny, przez co następuje deformacja chmury elektronowej i powstanie ładunków cząstkowych.
Są to cząstkowe ładunki dodatni i ujemny na wiążących się atomach, oznaczane symbolami δ+ oraz δ-.
Wartość ładunku cząstkowego występującego w cząsteczkach z wiązaniem kowalencyjnym spolaryzowanym jest znana jedynie z obliczeń. Doświadczalnie można zmierzyć wielkość, tzw. momentu dipolowego.
Moment dipolowy jest wielkością fizyczną, która charakteryzuje właściwości dipola elektrycznego.
Dipol elektryczny to układ składający się z dwóch ładunków punktowych o równych wartościach i przeciwnych znakach, znajdujących się w pewnej odległości od siebie.
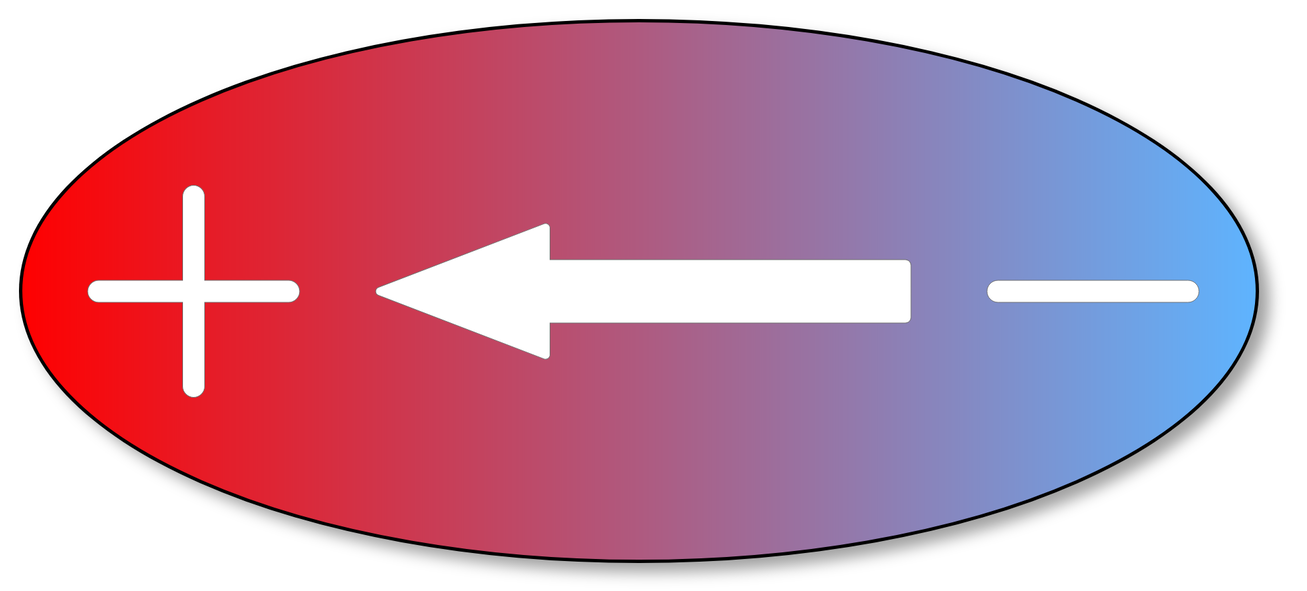
Grafika: Dipol elektryczny i elektryczny moment dipolowy*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Wiele cząsteczek z wiązaniem kowalencyjnym spolaryzowanym stanowi dipol. Takie cząsteczki mogą zostać uporządkowane w polu elektrycznym. Natężenie pola elektrycznego, jakie należy zastosować w celu zorientowania dipoli zgodnie z liniami sił pola elektrycznego, zależy od wartości ładunku na końcach dipola - d, i odległości miedzy ładunkami - l.
Miarą zdolności dipola do orientacji w polu elektrycznym jest iloczyn d·l, zwany momentem dipolowym, µ.
Przykłady:Cząsteczki chlorowodoru - każdy z atomów wchodzących w skład cząsteczki chlorowodoru, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej. Para elektronowa, znajdująca się pomiędzy atomami wodoru i chloru, nie należy jednak w jednakowym stopniu do obu atomów, ale jest przesunięta w kierunku tego, który silniej przyciąga elektrony (jest bardziej elektroujemny) – zatem w kierunku atomu chloru. Opisane wiązanie jest wiązaniem kowalencyjnym spolaryzowanym (wiązaniem atomowym spolaryzowanym). Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce chlorowodoru.
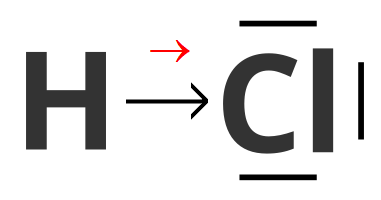
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki chlorowodoru*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
Cząsteczki wody - każdy z atomów wodoru wchodzących w skład cząsteczki wody, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej z atomem tlenu który na rzecz tworzonych wiązań oddaje dwa spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami wodoru i atomem tlenu, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnego atomu tlenu. Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce wody.
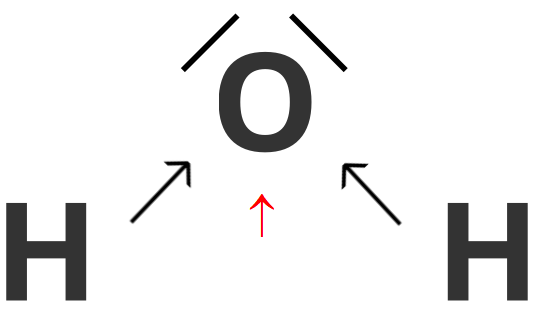
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki wody*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
Cząsteczka amoniaku - każdy z atomów wodoru wchodzących w skład cząsteczki amoniaku, oddaje po jednym elektronie walencyjnym w celu utworzenia wiążącej pary elektronowej z atomem azotu, który na rzecz tworzonych wiązań oddaje trzy spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami wodoru i atomem azotu, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnego atomu azotu. Strzałka w kolorze czerwonym wskazuje wypadkowy moment dipolowy w cząsteczce amoniaku.

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki chlorowodoru*. Źródło: epodręczniki.pl, licencja: CC BY-SA 3.0].
Cząsteczka tlenku węgla(IV) - każdy z atomów tlenu wchodzących w skład cząsteczki tlenku węgla(IV), oddaje po dwa elektrony walencyjne w celu utworzenia wiążących par elektronowych z atomem węgla, który na rzecz tworzonych wiązań oddaje cztery spośród swoich elektronów walencyjnych. Pary elektronowe, znajdujące się pomiędzy atomami tlenu i atomem węgla, nie należą jednak w jednakowym stopniu do wiążących się atomów, ale są przesunięte w kierunku bardziej elektroujemnych atomów tlenu. Z względu na geometrię cząsteczki tlenu węgla(IV) nie jest ona dipolem elektrycznym, ponieważ wypadkowy moment dipolowy w przypadku tej cząsteczki jest zerowy.
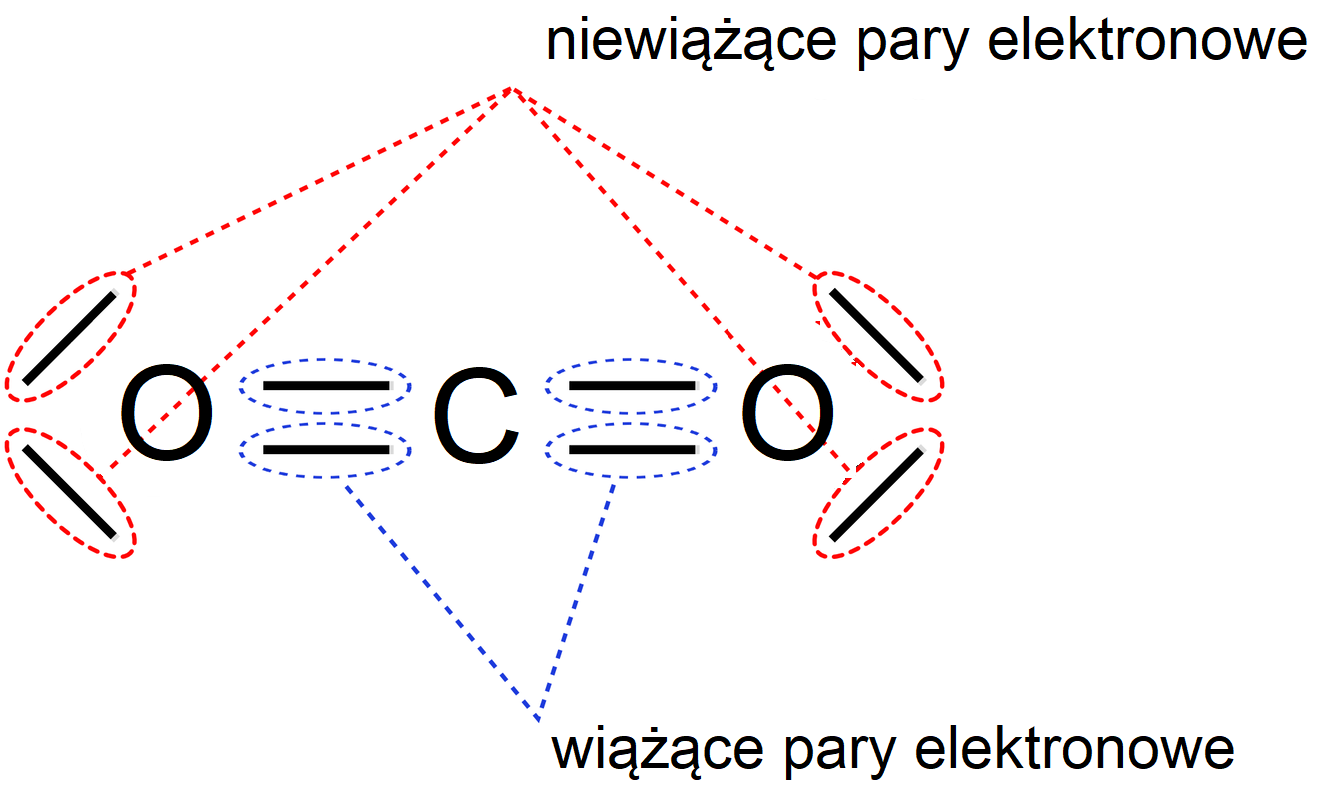
Grafika: Wzór elektronowy kreskowy cząsteczki dwutlenku węgla z wyróżnionymi rodzajami par elektronowych*. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0.
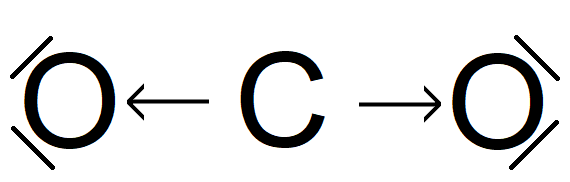
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0. [na podst. Wzór elektronowy kreskowy cząsteczki tlenku węgla(IV) z zaznaczeniem polaryzacji wiązań*. Źródło: Krzysztof Jaworski, Bożena Karawajczyk, epodreczniki.pl, licencja: CC BY-SA 3.0].
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

