Wiązania chemiczne
4. Wiązania kowalencyjne
4.3. Wiązanie koordynacyjne
Wiązanie koordynacyjne polega na uwspólnieniu pary elektronowej pochodzącej tylko od jednego z wiążących się atomów, zwanego donorem. Drugi atom, akceptor, uzupełnia własną powłokę walencyjną o elektrony pochodzące od donora. Graficznie wiązanie to zaznaczane jest strzałką skierowaną od atomu donora w kierunku atomu akceptora.
Przykłady:
1) W wyniku reakcji zachodzącej między cząsteczkami amoniaku i wody w roztworach wodnych, powstaje kation amonowy, w którym obecne jest wiązanie donorowo‑akceptorowe (koordynacyjne). Donorem elektronów w kationie amonowym jest atom azotu posiadający wolną parę elektronową, natomiast akceptorem – atom wodoru.
Poniżej zamieszczono schemat przedstawiający reakcję pomiędzy cząsteczką wody i amoniaku.
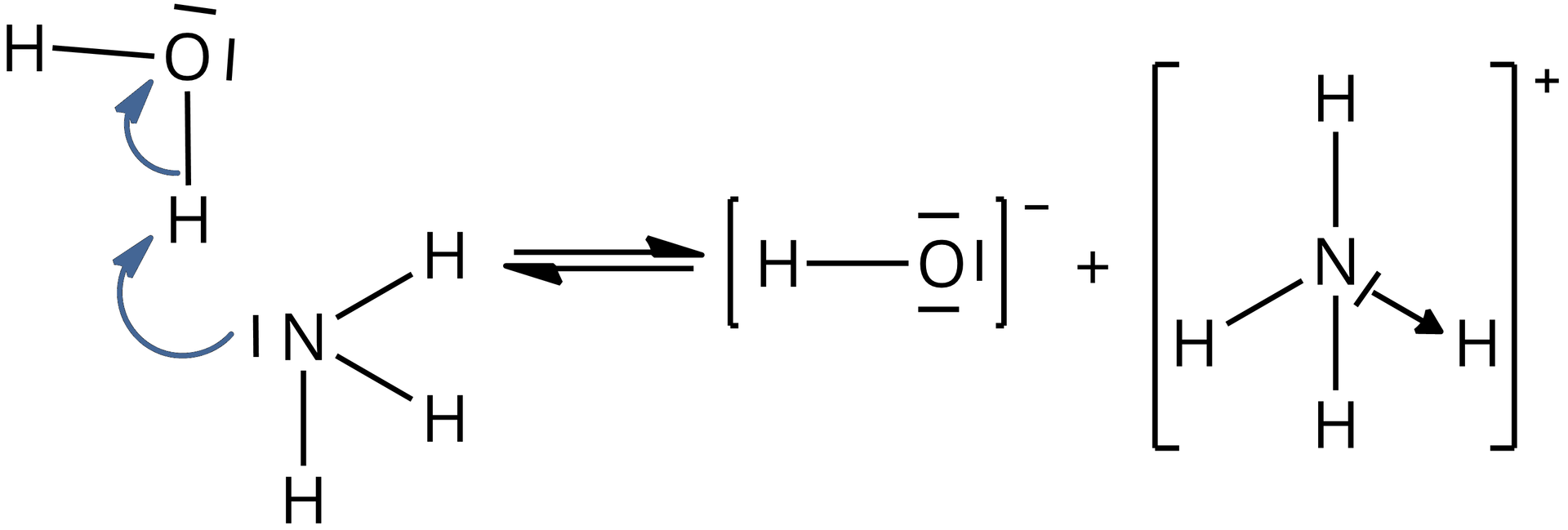
Grafika: Schemat przedstawiający reakcję pomiędzy cząsteczką wody i amoniaku*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
2) Woda w niewielkim stopniu ulega procesowi autodysocjacji. Przebieg tego procesu można zilustrować za pomocą równania reakcji.
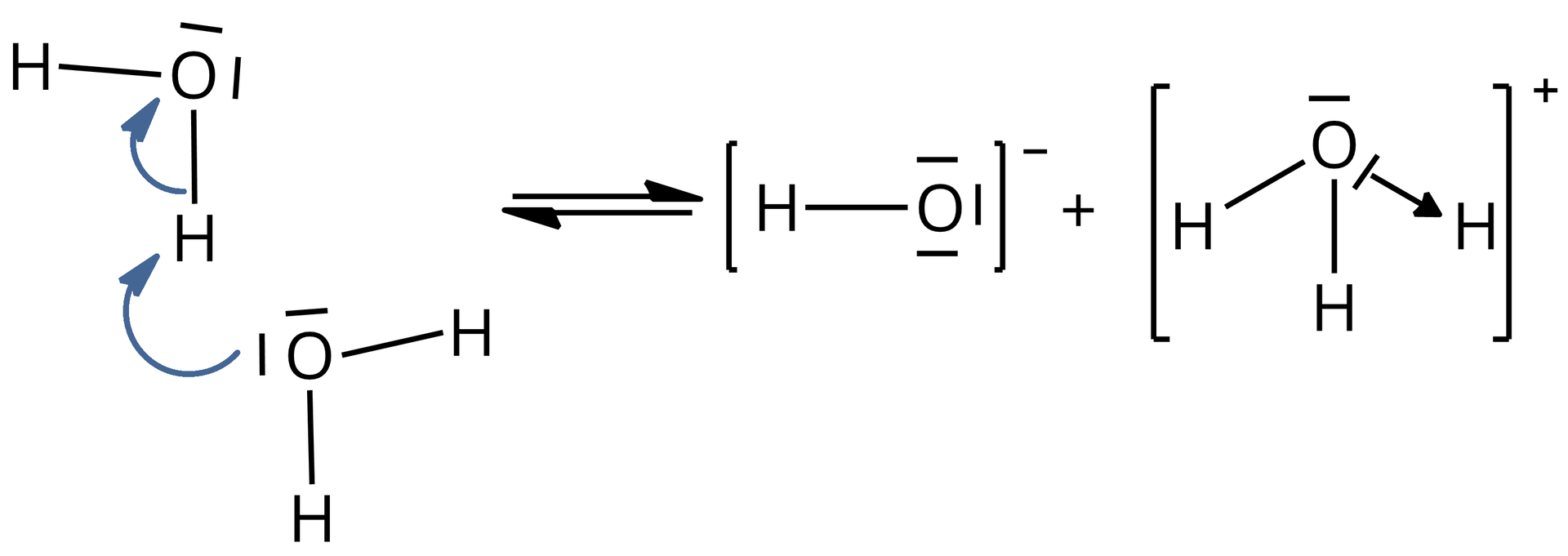
Grafika: Schemat powstawania jonu hydroniowego*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Pomiędzy cząsteczkami wody dochodzi do przemieszczenia się w jednym momencie dwóch elektronów. Tym samym powstaje anion wodorotlenkowy oraz dochodzi także do utworzenia wiązania koordynacyjnego, w wyniku czego z drugiej cząsteczki wody powstaje kation oksoniowy (kation hydroniowy, kation hydronowy). Donorem elektronów w kationie oksoniowym jest atom tlenu, natomiast akceptorem atom wodoru.
 Nurtuje Cię pytanie o Wiązanie koordynacyjne (donorowo-akceptorowe)*? Obejrzyj film, może uzyskasz odpowiedź.
Nurtuje Cię pytanie o Wiązanie koordynacyjne (donorowo-akceptorowe)*? Obejrzyj film, może uzyskasz odpowiedź.
Film: Wiązanie koordynacyjne (donorowo-akceptorowe)*. Źródło: GroMar Sp. z o. o., Piotr Dzwoniarek, licencja: CC BY-SA 3.0.
_________________
* Wykorzystano materiały zamieszczone na Zintegrowanej Platformie Edukacyjnej.

