Kształt cząsteczek
2. Hybrydyzacja
Hybrydyzacja orbitali jest działaniem matematycznym polegającym na dodawaniu funkcji falowych opisujących elektrony walencyjne tego samego atomu, należące do różnych podpowłok tej samej powłoki. Jako efekt zmieszania orbitali różnego typu uzyskuje się tzw. hybrydy. Hybrydyzację była stosowana jako metoda obliczania i przewidywania właściwości cząsteczek, obecnie ma już jedynie znaczenie historyczne.
 Obejrzyj film, który przybliży Ci "Co to jest hybrydyzacja?”*.
Obejrzyj film, który przybliży Ci "Co to jest hybrydyzacja?”*.
Film: Co to jest hybrydyzacja?*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Poniżej przedstawiono najpopularniejsze typy hybrydyzacji. Należy wskazać, iż suma indeksów w zapisie symbolu hybrydyzacji jest równa odpowiedniej liczbie przestrzennej, np.: sp2 (1+2=3) → Lp=3.
Typy hybrydyzacji:
- sp – hybrydyzacja digonalna (1+1=2) → Lp=2
 Przykłady: BeH2
Przykłady: BeH2
- sp2 – hybrydyzacja trygonalna (1+2=3) → Lp=3
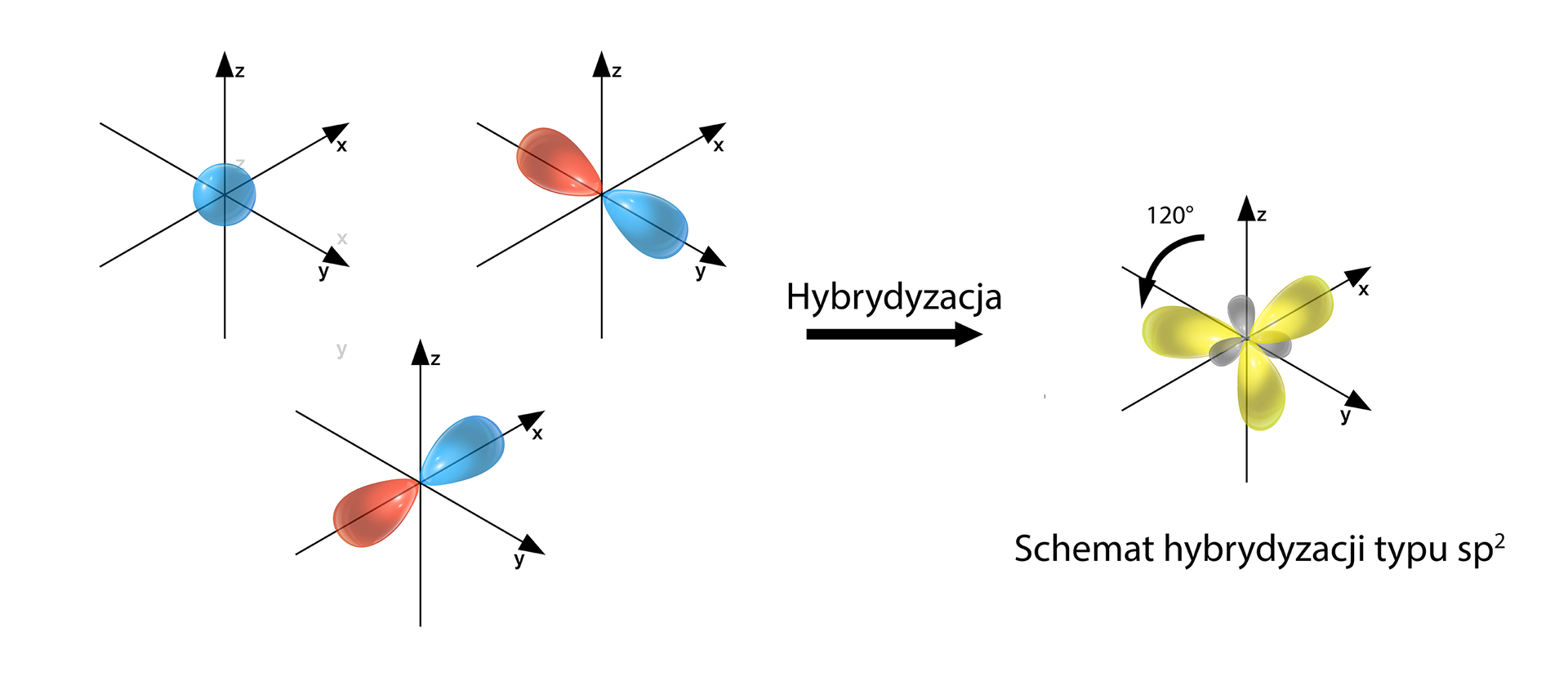 Przykłady: BH3
Przykłady: BH3
- sp3 – hybrydyzacja tetraedryczna (1+3=4) → Lp=4
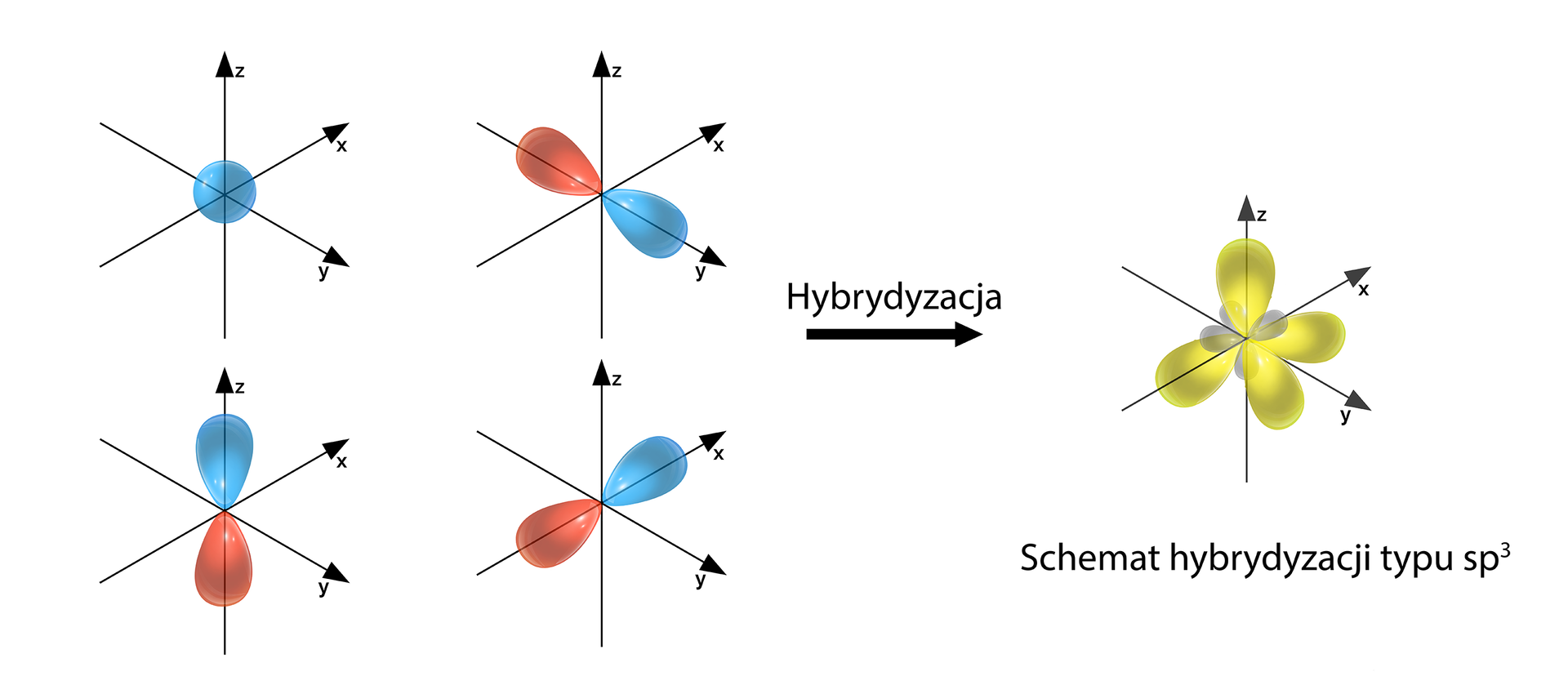
Przykłady: CH4
Grafiki: Schematy hybrydyzacji typu sp, sp2 i sp3*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Po przeanalizowaniu powyższych przykładów nasuwa się pytanie: Czy orbitale d też mogą brać udział w hybrydyzacji?
Hybrydyzacji mogą ulegać orbitale walencyjne podpowłoki typu s, p i d. W zależności od liczby i typu orbitali typu d biorących udział w hybrydyzacji, można wyróżnić kilka rodzajów hybrydyzacji:
sp3d - hybrydyzacja pentagonalna (1+3+1=5) → Lp=5
Przykłady: PCl5, SF4, ClF3, I3-
sp3d2 - hybrydyzacja heksagonalna (1+3+2=6) → Lp=6
Przykłady: SeF6, ClF5, XeF4
sp3d3 - hybrydyzacja heptagonalna (1+3+3=7) → Lp=7
Przykłady: IF7
 Dla lepszego zobrazowania wyniku działania hybrydyzacji w zakresie mieszania orbitali s, p i d zamieszczono animację "Czy orbitale typu d mogą ulegać hybrydyzacji?”*.
Dla lepszego zobrazowania wyniku działania hybrydyzacji w zakresie mieszania orbitali s, p i d zamieszczono animację "Czy orbitale typu d mogą ulegać hybrydyzacji?”*.
Animacja: Czy orbitale typu d mogą ulegać hybrydyzacji?”*. Źródło: GroMar Sp. z o.o., Dominika Kruszewska, licencja: CC BY-SA 3.0.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

