Tlenki, wodorotlenki, kwasy i sole w naukach o Ziemi i środowisku
4. Wodorotlenki
Związki zawierające atom metalu i jedną lub kilka grup wodorotlenowych o wzorze ogólny
M(OH)m
M – symbol danego metalu, n – liczba grup wodorotlenkowych w cząsteczce wodorotlenku.
Wodorotlenki mają budowę jonową Mn+ n(OH)-, a liczba jonów OH- zależy od stopnia utlenienia metalu, np. NaOH, Ca(OH)2, Fe(OH)3.
Podział

Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta –
Chemia. Repetytorium dla przyszłych maturzystów i studentów – wydanie 2014].
Nazwy
Nazwy tworzy się dwoma sposobami: 1) poprzez określenie liczby grup OH przedrostkami odliczebnikowymi i dodanie do nazwy metalu M, np. Fe(OH)2 - diwodorotlenek żelaza; lub 2) dodanie do słowa wodorotlenek nazwy metalu i w nawiasie podanie jego stopnia utlenienia. Zgodnie z umową, jeżeli dany pierwiastek w związkach chemicznych występuje tylko na jednym stopniu utlenienia, to nie jest konieczne podawanie go w nawiasie.
Przykłady
NaOH – wodorotlenek sodu
Ba(OH)2 – wodorotlenek baru
Al(OH)3 – wodorotlenek glinu
Fe(OH)2 – wodorotlenek żelaza(II) – diwodorotlenek żelaza
Fe(OH)3 – wodorotlenek żelaza(III) – triwodorotlenek żelaza
Mn(OH)2 – wodorotlenek manganu(II) – diwodorotlenek manganu
Mn(OH)4 – wodorotlenek manganu(IV) – tetrawodorotlenek manganu
Wodorotlenki
złożone to wodorotlenki zawierające różne metale, np.: Ca3Al2(OH)12.
Hydroksotlenki (oksowodorotolenki) to związki zbudowane z jonów M+, MOnm+, OH-, O2- w różnych kombinacjach, np.: FeO(OH).
Reakcje prowadzące do otrzymania wodorotlenków
Dwie najpopularniejsze z laboratoryjnych metod otrzymywania wodorotlenków przedstawiono na schemacie:
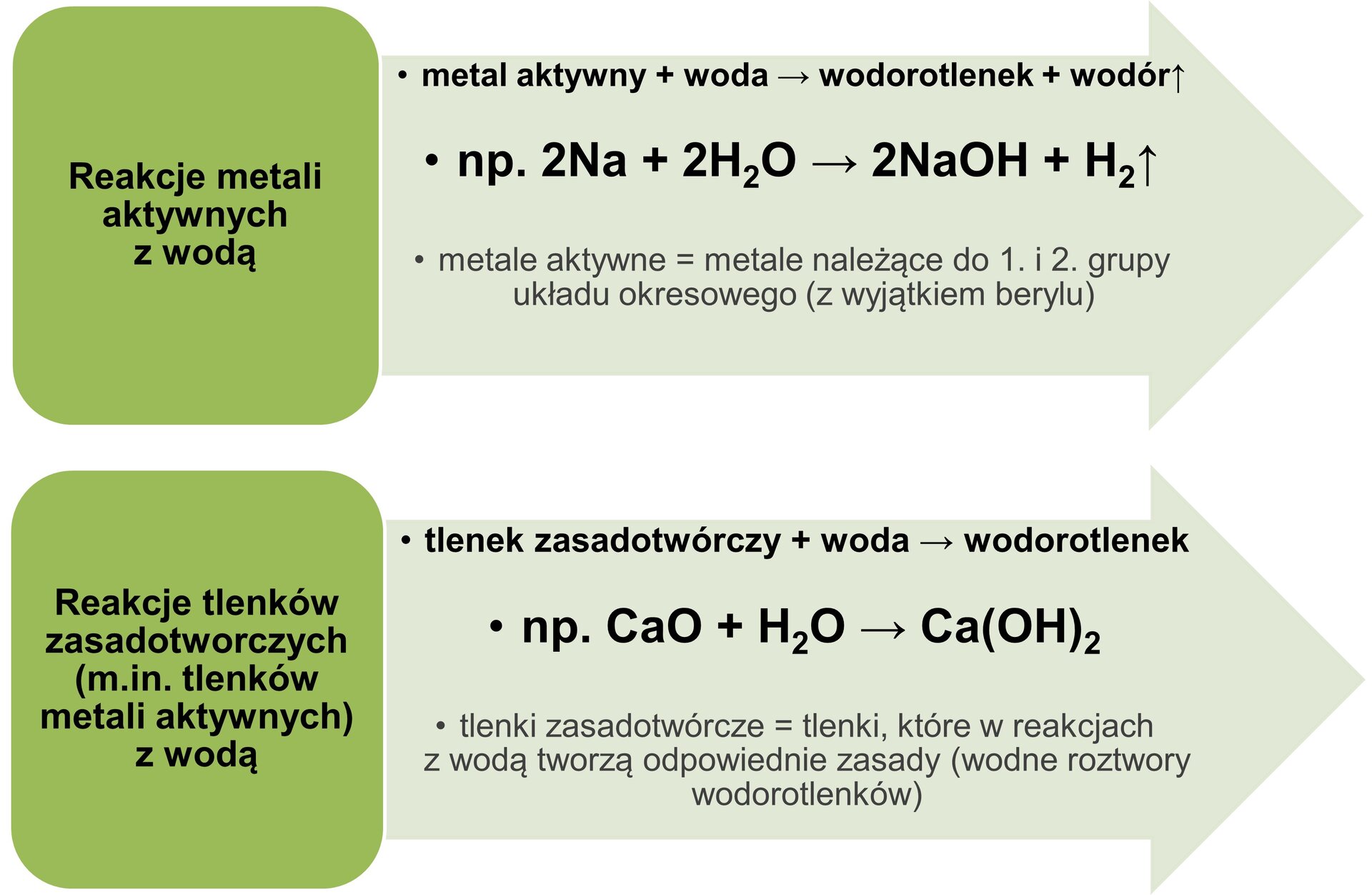
Grafika: Wybrane laboratoryjne metody otrzymywania wodorotlenków*.Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
- Reakcja aktywnego metalu bloku s z wodą
2Na + 2 H2O → 2 NaOH + H2↑
Źródło: Oficyna Pazdro, Reakcja sodu z wodą:Doświadczenie 7.11 , 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=2kefsQGPfo4.
2 K + 2 H2O → 2 KOH + H2↑
Mg + 2 H2O → Mg(OH)2 + H2↑
Ca + 2 H2O → Ca(OH)2 + H2↑
Źródło: Oficyna Pazdro, Badanie przebiegu reakcji metali lekkich z wodą: Doświadczenie 4.1, 02.10.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=f03OhP0tdI0.- Reakcja odpowiedniego tlenku metalu (blok s) z wodą
MgO + H2O → Mg(OH)2
Źródło: Oficyna Pazdro, Otrzymywanie tlenku magnezu i jego reakcja z wodą:Doświadczenie 7.9 , 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=xE1XZ4yZodA.
- Reakcja niektórych soli z innymi wodorotlenkami (reakcja strącania)
FeCl3 + 3 NaOH → Fe(OH)3↓ + 3 NaCl
Źródło: Oficyna Pazdro, Strącanie i roztwarzanie wodorotlenków żelaza: Doświadczenie 8.6, 26.03.2020 [dostęp: 22.12.2022].
Dostępne w YouTube: https://www.youtube.com/watch?v=4yLJNWb7FhE.
CuSO4 + 2 NaOH → Cu(OH)2↓ + 3 NaSO4
Źródło: Oficyna Pazdro, Reakcja siarczanu(VI) miedzi(II) z wodorotlenkiem sodu: Doświadczenie 8.5, 26.03.2020 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=PD0Mn-d8IYs.
- Reakcje niektórych wodorków z wodą
CaH2 + 2 H2O → Ca(OH)2↓ + 2 H2
Budowa i właściwości fizyczne
Wodorotlenki to ciała stałe o budowie jonowej, często zabarwione, o różnej rozpuszczalności w wodzie. Wodorotlenki litowców są bardzo dobrze rozpuszczalne w wodzie, słabiej rozpuszczalne są wodorotlenki berylowców, podczas gdy prawie wszystkie pozostałe związki tego typu są bardzo słabo rozpuszczalne.
Wodne roztwory niektórych wodorotlenków nazywamy ZASADAMI.
Roztwory zasadowe tworzą te wodorotlenki, które mają dostatecznie dużą rozpuszczalność w wodzie i ulegają w niej rozpadowi na jony, czyli dysocjują
NaOH → Na+ + OH-
Ca(OH)2 → Ca2+ + 2 OH-
Właściwości
takie są charakterystyczne wyłącznie dla wodorotlenków litowców – LiOH, NaOH,
KOH, RbOH, CsOH oraz niektórych berylowców – Ba(OH)2, Sr(OH)2,
Ca(OH)2. W przypadku wodorotlenków słabo rozpuszczalnych w wodzie dysocjują
tylko w niewielkim stopniu, co prowadzi do ustalenia stanu równowagi faza stała
– roztwór.
Moc wodorotlenków rośnie w grupach i maleje w okresach układu okresowego w miarę wzrostu liczby atomowej.
A czy wiesz, że zasadowy charakter cechuje także wodny roztwór amoniaku – NH3 · H2O, i pomimo, że nie istnieje wodorotlenek amonu, w wodnym roztworze tego związku, czyli wodzie amoniakalnej, zachodzi odwracalna reakcja
NH3 + H2O \( \rightleftharpoons \) NH4+ + OH- , a pojawiające się jony wodorotlenkowe są odpowiedzialne za właściwości zasadowe roztworu.
Źródło: Oficyna Pazdro, Otrzymywanie amoniaku i badanie jego rozpuszczalności w wodzie:Doświadczenie 4 PC2 , 26.05.2020
[dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=3yDReCiFJW4.
Właściwości chemiczne
- Reagują z kwasami w wyniku czego powstają sole
NaOH + HCl → NaCl + H2O
LiOH + HBr → LiBr + H2O
- Reagują z tlenkami kwasowymi, tworząc sole
2 Fe(OH)3 + 3 N2O5 → 2 Fe(NO3)3 + 3 H2O
Ca(OH)2 + SO3 → CaSO4 + H2O
- Wodorotlenki metali lekkich reagują z solami metali ciężkich, tworząc słabo rozpuszczalne wodorotlenki tych metali
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4
Na2CO3 + Ca(OH)2 → NaOH + CaCO3↓
- Wodne roztwory mocnych wodorotlenków roztwarzają niektóre metale
2 Al + 6 NaOH + 6 H2O → 2 Na3[Al(OH)6] + 3 H2↑
- Ulegają rozkładowi termicznemu na odpowiedni tlenek i wodę
2 AgOH → Ag2O + H2O
Hg(OH)2 → HgO + H2O
Cu(OH)2 → CuO + H2O
Źródło: Oficyna Pazdro, Otrzymywanie i rozkład termiczny wodorotlenku miedzi(II):Doświadczenie 4.9. ZP i 3.8. ZR , 02.10.2020 [dostęp: 22.12.2022]. Dostępne w YouTube: https://www.youtube.com/watch?v=TP0ToUpOz6w.
- Reakcje wymiany dla wodorotlenków o charakterze amfoterycznym
Wodorotlenki amfoteryczne: Al(OH)3, Cr(OH)3, Zn(OH)2, As(OH)3 – reagują zarówno z kwasami jak i z zasadami
Al(OH)3 + 3 HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na[Al(OH)4]
Na[Al(OH)4] → NaAlO2 + 2 H2O
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot

