Tlenki, wodorotlenki, kwasy i sole w naukach o Ziemi i środowisku
5. Kwasy
Związki zbudowane z atomów wodoru i reszty kwasowej o wzorze ogólnym
HnR
n – wartościowość reszty kwasowej R.
Podział
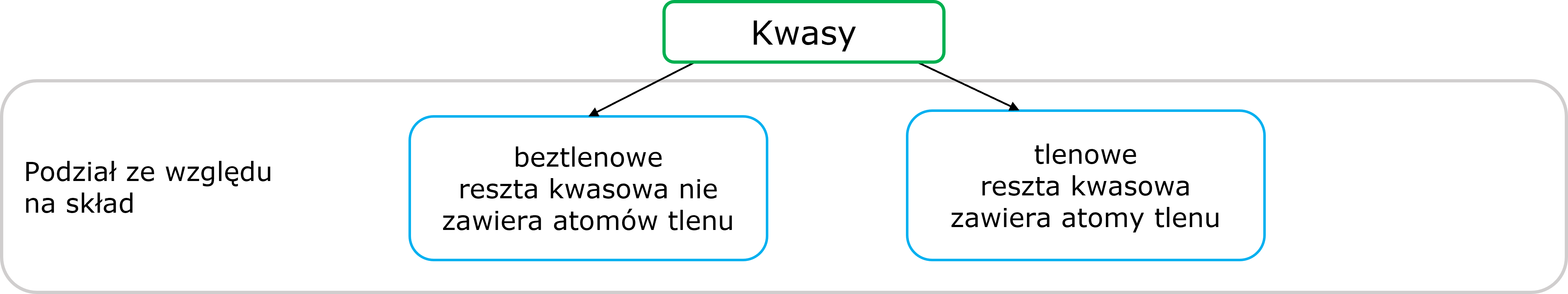
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0
[na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta –
Chemia. Repetytorium dla przyszłych maturzystów i studentów – wydanie 2014].
Nazwy
Ogólnie nazwy kwasów beztlenowych tworzy się dodając do nazwy pierwiastka tworzącego kwas końcówkę "wodorowy".
- kwas chlorowodorowy, kwas solny HCl(aq)
- kwas fluorowodorowy HF(aq)
- kwas bromowodorowy HBr(aq)
- kwas jodowodorowy HI(aq)
- kwas siarkowodorowy H2S(aq)
Nazwy kwasów tlenowych wywodzą się od nazwy niemetalu z końcówką „-owy”. Jeżeli ten sam pierwiastek tworzy kwasy na różnych stopniach utlenienia, to w nawiasie za nazwą podaje się wartościowość tego niemetalu w danym kwasie. Jest to nomenklatura kwasowa skrócona, usunięta z zaleceń PTChem. Obok podano również nazwy kwasowe systematyczne, w których na końcu podany jest ładunek anionu (reszty kwasowej).
- H2SO3 – kwas siarkowy(IV) – kwas trioksosiarkowy(2-)
- H2SO4 – kwas siarkowy(VI) – kwas tetraoksosiarkowy(2-)
- HNO3 – kwas azotowy(V) – kwas trioksoazotowy(1-)
- HNO2 – kwas azotowy(III) – kwas dioksoazotowy(1-)
- H3PO4 – kwas ortofosforowy(V) – kwas tetraoksofosforowy(3-)
- H2CO3 – kwas węglowy – kwas trioksowęglowy(2-) *
* ponieważ kwas węglowy jest kwasem nietrwałym za bardziej poprawny uważa się zapis wzoru w postaci H2O · CO2.
Dla rozszerzenia i utrwalenia wiedzy obejrzyj film Nomenklatura kwasów.
Film: Nomenklatura kwasów*. Źródło: Piotr Dzwoniarek, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania kwasów
Poniższy schemat przedstawia dwie spośród metod otrzymywania kwasów.

Grafika: Wybrane laboratoryjne metody otrzymywania kwasów nieorganicznych*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania kwasów beztlenowych
- Rozpuszczanie wodorków niemetali w wodzie
H2 + Cl2 → 2 HCl HCl(gaz) + H2O → HCl(aq)
Źródło: Oficyna Pazdro, Otrzymywanie chlorowodoru i kwasu chlorowodorowego (cz. 1): Doświadczenie 7.6 (cz. 1), 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=3aR1b_CXY0g.
Źródło: Oficyna Pazdro, Otrzymywanie chlorowodoru i kwasu chlorowodorowego (cz. 2): Doświadczenie 7.6 (cz. 2), 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=Od3xKceZAWE.
H2 + S → H2S H2S(gaz) + H2O → H2S(aq)
- Reakcje niektórych niemetali z wodą
Cl2 + H2O → HCl + HClO (podobnie reagują brom i jod)
Reakcje prowadzące do otrzymywania kwasów tlenowych
- Reakcje tlenków niemetali o charakterze kwasowym z woda
N2O5+ H2O → 2 HNO3
SO3 + H2O → H2SO4
P4O10 + 6 H2O → 4 H3PO4
Źródło: Oficyna Pazdro, Spalanie fosforu i otrzymywanie kwasu fosforowego(V): Doświadczenie 7.5, 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=mgD44czTnm0.CO2 + H2O → H2O · CO2
N2O3+ H2O → 2 HNO2
SO2 + H2O → H2SO3
- Strącania
osadu, jeżeli kwas jest słabo rozpuszczalny
H2SO4 + Na2SiO3 → H2SiO3↓ + Na2SO4
- Powstawania słabego elektrolitu, lub nietrwałego kwasu
CaS + HNO3 → Ca(NO3)2 + H2S↑ lub CaCO3 + HCl → CaCl2 + H2O · CO2
Budowa i właściwości fizyczne
Kwasy rozpuszczalne w wodzie są elektrolitami, dysocjują w wodzie na jony H+ i aniony reszty kwasowej.
HCl → H+ + Cl-
H2SO4 → 2 H+ + SO42-
Stężone roztwory kwasów są żrące, a rozcieńczając je należy bezwzględnie przestrzegać zasady "PAMIĘTAJ CHEMIKU MŁODY WLEWAJ ZAWSZE KWAS DO WODY".
Źródło: Oficyna Pazdro, Badanie właściwości kwasu siarkowego(VI): Doświadczenie 7.3, 26.03.2020
[dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=aX3S59anV2I.
Źródło: Oficyna Pazdro, Badanie właściwości kwasu azotowego(V): Doświadczenie 7.4, 26.03.2020 [dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=hbbk1248JYk.
Właściwości chemiczne
- Reakcje kwasowo-zasadowe – reakcje neutralizacji (zobojętniania)
KOH + HCl → KCl + H2O
NaOH + HNO3
→ NaNO3 +
H2O
- Reakcje wymiany w roztworach wodnych, głównie w reakcjach z tlenkami metali i solami
Na2O + HNO3 → NaNO3 + H2O
CuO + 2 HCl → CuCl2 + H2O
Na2CO3 + 2 HNO3 → NaNO3 + H2O + CO2
CaS + 2 HNO3 → Ca(NO3)2 + H2S↑
- Reakcje z metalami
Mg + 2 HCl → MgCl2 + H2↑
Zn + 2 HCl → ZnCl2 + H2↑
Fe + 2 HCl → FeCl2 + H2↑
Źródło: Oficyna Pazdro, Reakcje metali z kwasem solnym: Doświadczenie 7, 26.05.202 [dostęp: 20.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=Gj_Dh8vBhiA.
Reakcji takiej nie ulegają metale szlachetne, takie jak złoto, srebro, rtęć czy miedź. Mogą natomiast ulegać reakcjom z kwasami utleniającymi, w reakcjach tych nie wydziela się jednak wodór
Cu + H2SO4 (stężony) → CuSO4 + SO2 + 2 H2O
Cu + 4 HNO3 (stężony) → Cu(NO3)2 + 2 NO2 + 2H2O
Podział na metale aktywne i nieaktywne w reakcji z kwasami ma swoje uzasadnienie w szeregu elektrochemicznym metali.
Grafika: Szereg aktywności metali*. Źródło: epodreczniki.pl, licencja: CC BY-SA 3.0.
Moc kwasów beztlenowych
- rośnie w obrębie okresu od lewej do prawej i maleje w obrębie grupy od dołu do góry.
Moc kwasów tlenowych
- rośnie ze wzrostem elektroujemności centralnego atomu reszty kwasowej, zarówno w okresach jak i w grupach,
- rośnie (poza nielicznymi wyjątkami) ze wzrostem liczby atomów tlenu.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.
Ikona (źródło): Reshot



