3.2 Teoria wiązań G. Lewisa i W. Kossela
Zgodnie z tą teorią atomy tworząc wiązanie chemiczne mogą uzyskać stabilną konfigurację elektronową (dubletową lub oktetową) na drodze przekazania elektronów jednego atomu drugiemu lub przez uwspólnienie (współużytkowanie) elektronów walencyjnych. Pierwszy sposób prowadzi do powstania wiązania heteropolarnego (jonowego), a drugi do kowalentnego (atomowego) lub donorowo-akceptorowego (koordynacyjnego). To, jakiego rodzaju wiązanie dochodzi do skutku, zależy od właściwości pierwiastków tworzących związek chemiczny. Można je scharakteryzować za pomocą elektroujemności, które jest umowną miarą skłonności atomu do przyciągania elektronów podczas tworzenia wiązania. Pojęcie to zostało wprowadzone przez L. Paulinga po utworzeniu teorii wiązań Lewisa – Kossela, ale jest przydatne do zrozumienia teorii wiązań. Wprowadzona skala elektroujemności opiera się na energii jonizacji, a także w późniejszych modyfikacjach na powinowactwie elektronowym pierwiastków. Energia jonizacji pierwiastków to energia jaka trzeba doprowadzić do atomu, aby usunąć elektron z atomu i utworzyć jon dodatni. Np.:
![]()
Energia jonizacji zależy od właściwości chemicznych pierwiastków. Dla pierwiastków drugiego okresu układu okresowego przedstawiono ją w tabeli 6.
Tabela 6. Energia jonizacji wybranych pierwiastków.

Wartości energii jonizacji wskazują, że najłatwiej tworzą kationy pierwiastki pierwszych grup układu okresowego. Stosunkowo łatwe jest pozbawienie litu elektronu 2s1. Najtrudniej oderwać elektron od gazu szlachetnego – neonu, który posiada komplet elektronów na swej powłoce walencyjnej 2s2p6. Niewiele mniej energii należy doprowadzić do układu, aby stworzyć dodatnie jony fluoru czy tlenu, co powoduje, że nieznane są stabilne jony O1+ czy F1+. Zatem energia jonizacji zależy od struktury elektronowej pierwiastka. Potwierdzają to inne dane zawarte w tabeli 6. Łatwiejszej jonizacji ulega bor niż beryl. Jest to wynikiem mniejszego zapotrzebowania na energię przy odrywaniu elektronu z orbitalu 2p1 niż z orbitalu 2s2:
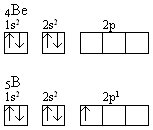
Podobne zjawisko obserwuje się przy porównaniu jonizacji azotu i tlenu, gdzie łatwiejsze jest oderwanie czwartego elektronu z orbitalu 2p4 niż trzeciego ze względnie stabilnej konfiguracji 2p3:
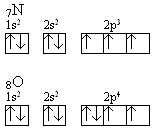
Energia jonizacji zmienia się periodycznie w układzie okresowym pierwiastków, zarówno przy przechodzeniu wzdłuż okresów, jak i wewnątrz grup układu okresowego, co pokazano na rys.15.
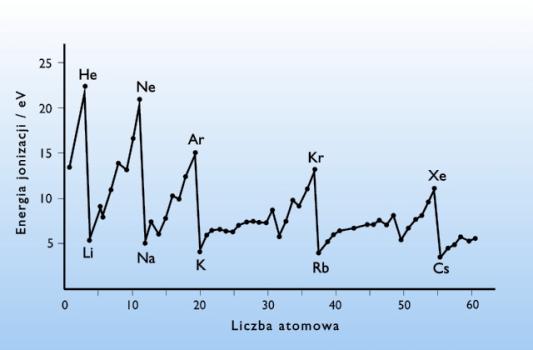
Rysunek 15. Energia jonizacji pierwiastków w zależności od liczby atomowej.
Największe wartości energii jonizacji posiadają helowce, a najmniejsze litowce. Pozostałe pierwiastki bloków s i p charakteryzują się wartościami pośrednimi. Dodatkowo można zauważyć zmniejszanie się energii jonizacji wraz ze wzrostem liczby atomowej wewnątrz grup układu okresowego.
Powinowactwo elektronowe jest to ilość energii, jaka wydziela się przy przyłączaniu elektronu do obojętnego atomu. Jest to zatem ilość energii jaka powstaje w wyniku tworzenia się jonu ujemnego. Np.:
![]()
Jak wiadomo jony takie łatwo tworzą pierwiastki niemetaliczne i dla nich jest możliwy bezpośredni pomiar powinowactwa. Posługując się wartościami energii jonizacji EJ oraz powinowactwa elektronowego PE można obliczyć elektroujemności X w skali Paulinga (metoda Mullikena):
![]()
Wartości elektroujemności wg L. Paulinga dla poszczególnych pierwiastków podano w tabeli 7.
Wartości elektroujemności zawierają się one w przedziale 0,7 (cez) – 4,0 (fluor). Pierwiastki o wysokich wartościach elektroujemności gromadzą się wokół prawego górnego rogu układu okresowego (z wyłączeniem gazów szlachetnych), a po przekątnej w dolnym lewym rogu grupują się pierwiastki o małej elektroujemności. Zależność elektroujemności jako w funkcji liczby atomowej przedstawiono na rys.16.
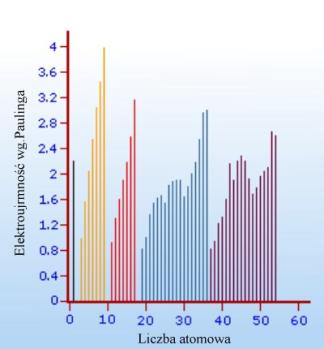
Rysunek 16. Elektroujemność pierwiastków w skali Paulinga w zależności od liczby atomowej pierwistka.
Znając wartości elektroujemności pierwiastków tworzących związek chemiczny można określić charakter wiązania chemicznego. Jeśli różnica elektroujemności między dwoma pierwiastkami jest niewielka lub równa zeru, to wiązanie ma charakter kowalentny. Wraz ze wzrostem różnicy elektroujemności narasta udział wiązania jonowego. Przy różnicy dochodzącej do 1,7 mówi się o wiązaniu atomowym spolaryzowanym. Przyjmuje się, że przy różnicy 1,7 udział wiązania jonowego wynosi 50%. Powyżej tej wartości związek ma charakter jonowy. Wykres podający zależność między jonowym charakterem związku chemicznego, a różnicą w elektroujemności tworzących go pierwiastków podano na rys. 17.
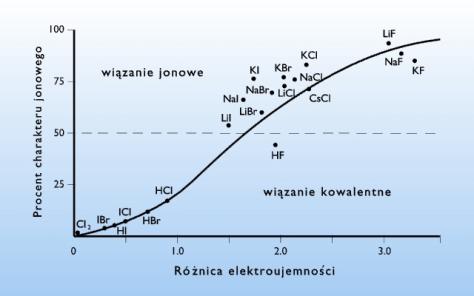
Rysunek 17. Charakter wiązania chemicznego w zależności od różnicy elektroujemności pierwiastków w związku chemicznym.
Teoria wiązań Lewisa i Kossela w sposób obrazowy oddaje charakter wiązań chemicznych. Ze względu na swoją poglądowość i klarowność jest powszechnie uwzględniana w podręcznikach chemii ogólnej, mimo że znane są odstępstwa od reguły oktetu elektronowego w związkach typu SF6 lub PCl5.