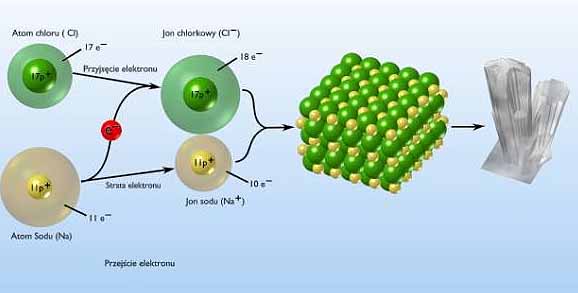
3.2.1 Wiązanie jonowe
W ten sposób wiążą się pierwiastki o dużej różnicy w skali elektroujemności Paulinga. Mogą to być pierwiastki pierwszych i ostatnich grup układu okresowego (z wyłączeniem grupy 18). Podczas reakcji sodu i chloru atomy obydwóch pierwiastków zbliżają się do siebie i następuje nakładanie się ich orbitali atomowych. Struktura elektronowa atomów jest następująca:
11Na 1s2 2s2p6 3s1
17Cl 1s2 2s2p6 3s2p5
W stosunku do konfiguracji oktetowej atom sodu ma nadmiar jednego elektronu, a atom chloru brak jednego elektronu. Jeśli dojdzie do przeskoku elektronu 3s1 sodu na walencyjną orbitę chloru, to konfiguracja elektronowa obu atomów będzie nastepująca:
11Na 1s2 2s2p6
17Cl 1s2 2s2p6 3s2p6
Obydwa atomy będą posiadały oktet elektronowy – tę uprzywilejowaną energetycznie konfigurację gazów szlachetnych: neonu i argonu. W miejsce dotychczas obojętnych atomów pojawią się jony. Atom sodu ma 11 protonów w jądrze i 10 elektronów, a więc jest jednododatnim kationem sodu, a atom chloru mając przewagę elektronu (17p, 18e) staje się anionem. Między obydwoma jonami działają siły elektrostatycznego przyciągania. Siły te mają charakter sferyczny (nie są ukierunkowane w przestrzeni), toteż związki chemiczne powstające z udziałem wiązania jonowego tworzą kryształy jonowe (rys.18).