1.4
Wiązanie
wodorowe (mostki wodorowe)
Jednym ze szczególnych oddziaływań
międzycząsteczkowych jest wiązanie wodorowe.
Występuje ono pomiędzy kowalentnie
(I.3.2.2) związanym atomem wodoru, a elektroujemnymi atomami sąsiedniej cząsteczki.Rys. 1.03 przedstawia
najmocniejsze tego rodzaju wiązanie tworzące się pomiędzy cząsteczkami
flurowodoru. Elektrododatni atom wodoru oddziaływuje elektrostatycznie z
elektroujemnym atomem fluoru. Energia tego wiązania wynosi
![]() .
.
Rys. 1.04 ilustruje z kolei wiązanie wodorowe pomiędzy cząsteczkami wody.
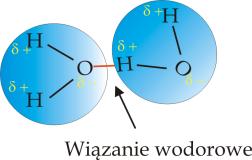
Rys. 1.04. Wiązania wodorowe pomiędzy cząsteczkami wody.
Tworzenie
się wiązań wodorowych ma silny wpływ na własności wielu związków. W tablicy
1.3 porównano niektóre własności wodorków
niemetali. Dla analogicznych wodorków w obrębie danej grupy układu
okresowego, dla których wiązania wodorowe nie mają istotnego znaczenia,
temperatura wrzenia i topnienia rośnie
wraz ze wzrostem masy cząsteczkowej (grupa IV i VIII). Wodorki z
pierwiastkami grupy V, VI i VII zachowują się nieco inaczej (rys.
1.05). Substancje o
małej masie molowej:
![]() ,
,
![]() ,
,
![]() posiadają anomalnie wysokie
temperatury wrzenia i topnienia (porównaj
posiadają anomalnie wysokie
temperatury wrzenia i topnienia (porównaj
![]() i
i
![]() ,
,
![]() i
i
![]() oraz
oraz
![]() i
i
![]() ) w porównaniu z ich cięższymi analogami. Ta nieoczekiwanie wysoka
temperatura potrzebna jest do zniszczenia silnych wiązań wodorowych
przy uwalnianiu cząsteczek w czasie zmian stanu skupienia.
) w porównaniu z ich cięższymi analogami. Ta nieoczekiwanie wysoka
temperatura potrzebna jest do zniszczenia silnych wiązań wodorowych
przy uwalnianiu cząsteczek w czasie zmian stanu skupienia.
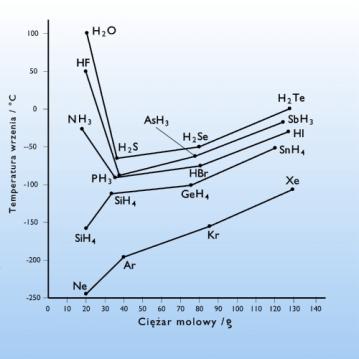
Rys.1.05. Temperatura wrzenia wybranych wodorków i gazów szlachetnych.
Wiązania wodorowe mają duże znaczenie w budowie materii organicznej. Rys. 1.06 pokazuje podwójną spiralę DNA, w której dwa łańcuchy DNA połączone są mostkami wodorowymi (1.06a i 1.06b).
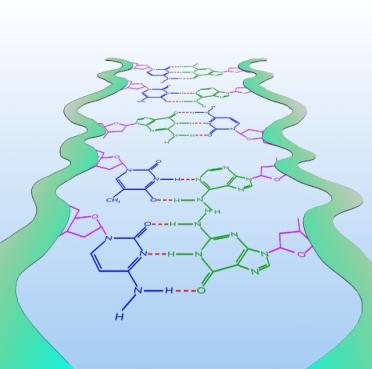
Rys.1.06. Schemat połączenia dwóch łańcuchów DNA poprzez mostki wodorowe.
Rys.1.06a i b. Mostki wodorowe pomiędzy zasadowymi połączeniami azotowymi (a) cytozyna-guanidyna (trzy mostki wodorowe) (b) tymina adenina (dwa mostki wodorowe) łączące łańcuchy DNA.
W tablicy 1.3. przedstawiono własności fizykochemiczne wybranych wodorków niemetali.