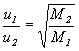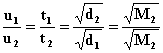2.1.3 Dyfuzja gazów
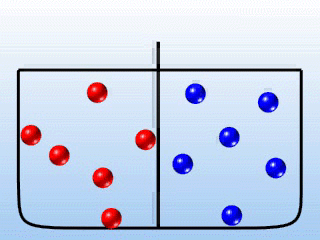
Samorzutne rozprzestrzenianie się cząsteczek wywołane nieustannym ruchem molekularno-kinetycznym nazywamy dyfuzją (rys.2.09). Dyfuzję wykazują gazy, ciecze, a nawet cząstki stałe. Najszybciej proces dyfuzji przebiega w gazach.
Kliknij na rysunek aby zobaczyć animacje.
Rys. 2.09 Mieszanie się gazów A i B wskutek zjawiska dyfuzji.
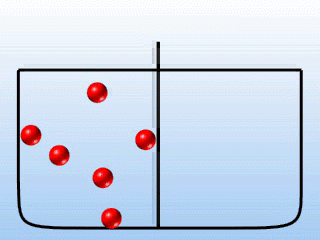
Analogiczne zjawisko polegające na wypływie cząstek gazu ze zbiornika przez wąski otwór nazywamy efuzją (rys.2.10).
Kliknij na rysunek aby zobaczyć animacje.
Rys.2.10 Zjawisko efuzji gazu.
Szybkość dyfuzji i efuzji gazów w stałej temperaturze i przy stałej różnicy ciśnień zależy od szybkości ruchu cząsteczek, a więc od gęstości gazów i przebiega według prawa dyfuzji Grahama:
gdzie:
u - szybkość dyfuzji,
t - czas wypływu gazu (w przypadku efuzji),
d - gęstość gazu,
M – masa cząsteczkowa gazu.
Prawo dyfuzji Grahama zostało praktycznie wykorzystane do rozdzielania gazów (np. argonu i neonu). Można je wykorzystać do wyznaczania masy molowej gazów.
Zależność (2.35) wynika z kinetyczno-molekularnej koncepcji gazu doskonałego. Jeśli z równania (2.11) wyliczymy prędkość cząsteczki u to uzyskamy zależność:
![]()
stąd:
![]()
Dla
równo molowej mieszaniny dwóch gazów o masie cząsteczkowej
![]() słuszne są zależności:
słuszne są zależności:
![]()
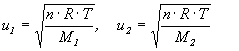
stąd: