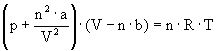2.1.4 Gaz rzeczywisty
Model
gazu doskonałego jest modelem „idealnym”. W rzeczywistości w pewnych
ekstremalnych warunkach (wysokie ciśnienia, niskie temperatury) zachowanie
gazu nie można opisać prawami gazu doskonałego. Mówimy wtedy o gazie
rzeczywistym. Rys. 2.11 ilustruje wpływ ciśnienia na odstępstwo od
doskonałego zachowania jednego mola wybranego gazu w temperaturze 00C.
Dla mola gazu doskonałego mamy
![]() . Wodór i hel wykazuje w tej temperaturze odstępstwo dodatnie natomiast
pozostałe gazy początkowo odstępstwo ujemne, a przy wysokich ciśnieniach
dodatnie.
. Wodór i hel wykazuje w tej temperaturze odstępstwo dodatnie natomiast
pozostałe gazy początkowo odstępstwo ujemne, a przy wysokich ciśnieniach
dodatnie.
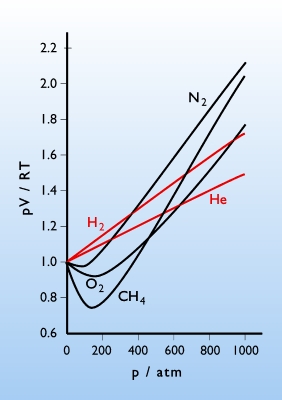
Rys.2.11.
Odstępstwa od doskonałego zachowania się jednego mola gazu wywołane
wzrostem ciśnienia. Dla jednego mola gazu doskonałego ![]() .
W przypadku gazów:
.
W przypadku gazów: ![]() odziaływanie
pomiędzy cząsteczkami powoduje spadek wartości
odziaływanie
pomiędzy cząsteczkami powoduje spadek wartości ![]() poniżej
jedności. Dla wszystkich gazów wraz ze wzrostem ciśnienia rośnie udział
objętości własnej cząsteczek co daje przeważnie wzrost
poniżej
jedności. Dla wszystkich gazów wraz ze wzrostem ciśnienia rośnie udział
objętości własnej cząsteczek co daje przeważnie wzrost ![]() powyżej
jedności. Ten ostatni efekt obserwowany jest dla wodoru i helu.
powyżej
jedności. Ten ostatni efekt obserwowany jest dla wodoru i helu.
Różnice w zachowaniu się gazu rzeczywistego i doskonałego wynikają z dwóch przyczyn. Po pierwsze, w gazach rzeczywistych duży wpływ wywierają oddziaływania międzycząsteczkowe, i po drugie, nie może być zaniedbana objętość własna cząsteczek w stosunku do całkowitej objętości zajmowanej przez gaz. Biorąc pod uwagę oddziaływania międzycząsteczkowe i wpływ objętości własnej Van der Waals zaproponował równanie stanu dla gazu rzeczywistego:
Wyraz
![]() oznacza korektę
ciśnieniową, gdzie n jest liczbą moli, V – objętością,
a - stałą charakterystyczną dla danego gazu.
oznacza korektę
ciśnieniową, gdzie n jest liczbą moli, V – objętością,
a - stałą charakterystyczną dla danego gazu.
W
miarę wzrostu ciśnienia gazu siły międzycząsteczkowe odgrywają coraz
większą rolę i gaz zmniejsza swoją objętość bardziej niżby to wynikało
z równania gazów doskonałych. Rezultat jest taki jakby na gaz działało
dodatkowe ciśnienie. Wyrażenie
![]() jest poprawką na ciśnienie i
nosi nazwę ciśnienia wewnętrznego.
jest poprawką na ciśnienie i
nosi nazwę ciśnienia wewnętrznego.
Poprawka n·b związana jest z objętością własną cząsteczek. Uwzględnia fakt, że podczas sprężania gazu ulega zmianie nie cała objętość zajmowana przez gaz, a jedynie przestrzeń pusta nie zajęta przez cząsteczki gazu. Należy objętość V zmniejszyć o wielkość n·b, gdzie b oznacza rzeczywistą objętość zajmowaną przez cząsteczki jednego mola gazu. Stałe a i b wyznacza się doświadczalnie. Przykłady stałych Van der Waalsa podano w tablicy 2.2.
Tablica 2.2. Stałe Van der Waalsa oraz temperatura krytyczna dla wybranych gazów.
|
Gaz |
Symbol |
|
|
|
|
Amoniak |
|
4,17 |
0,037 |
132 |
|
Argon |
|
1,35 |
0,037 |
-123 |
|
Azot |
|
1,39 |
0,039 |
-147 |
|
Dwutlenek węgla |
|
3,59 |
0,043 |
31 |
|
Etan |
|
5,49 |
0,064 |
|
|
Etylen |
|
4,47 |
0.057 |
|
|
Hel |
|
0,034 |
0,024 |
-268 |
|
Ksenon |
|
4,19 |
0,051 |
17 |
|
Powietrze |
|
1,4 |
0,039 |
|
|
Tlen |
|
1,36 |
0,032 |
-118 |
|
Wodór |
|
0,244 |
0,027 |
-240 |