5.2 Przewodnictwo elektrolitów
(przewodnictwo właściwe, opór właściwy, przewodnictwo równoważnikowe, prawo niezależnej wędrówki jonów Kohlrauscha)
Obecność jonów jest przyczyną przewodnictwa elektrolitycznego roztworów. Rys. 5.2 przedstawia ruch jonów w polu elektrycznym. Jony dodatnie (kationy) przemieszczają się w kierunku bieguna ujemnego, natomiast jony ujemne (kationy) w kierunku bieguna dodatniego (anody).
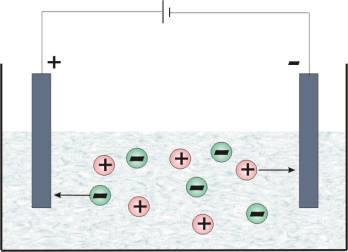
Rys.5.2. Ruch jonów w polu elektrycznym zapewniający przewodnictwo elektrolityczne roztworu.
Miarą
przewodnictwa elektrolitu jest przewodnictwo właściwe, które definiujemy
jako przewodnictwo 1cm3 roztworu. Przewodnictwo
właściwe
![]() można obliczyć ze
wzoru:
można obliczyć ze
wzoru:
Przewodnictwo właściwe
(5.18)
![]()
gdzie R [om] jest oporem warstewki elektrolitu o przekroju S [cm2] i długości l [cm].
Odwrotnością przewodnictwa właściwego jest opór właściwy r:
Opór
właściwy
(5.19)
![]()
Przewodnictwo roztworu zależy od stężenia i ruchliwości jonów. Ta ostatnia wielkość limitowana jest rodzajem jonu (wielkość, ładunek) oraz rodzajem rozpuszczalnika. Dla roztworów rozcieńczonych wzrost stężenia powoduje wzrost przewodnictwa. W przypadku roztworów stężonych wzajemne oddziaływanie jonów ogranicza ich ruchliwość i może powodować zmniejszenie przewodnictwa. Rys. 5.3. ilustruje wpływ stężenia na przewodnictwo właściwe wybranych wodnych roztworów elektrolitów.
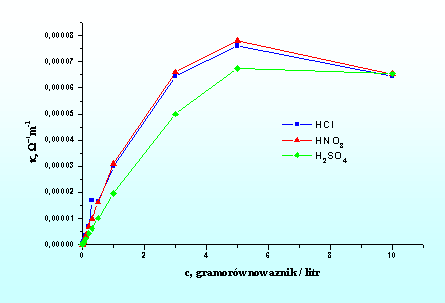
Rys. 5.3. Wpływ stężenia na przewodnictwo wodnych roztworów elektrolitów.
W celu porównania przewodnictwa roztworów wprowadzono pojęcie przewodnictwa równoważnikowego. Jest to przewodnictwo właściwe odniesione do przewodnictwa centymetrowej warstewki roztworu zawierającej jeden gramorównoważnik substancji.
Przewodnictwo równoważnikowe można zatem wyrazić wzorem:
Przewodnictwo równoważnikowe
(5.20)
![]()
gdzie c oznacza stężenie normalne roztworu.
Rys.5.4.
przedstawia przewodnictwo równoważnikowe mocnych elektrolitów (
![]() ) oraz elektrolitu słabego (
) oraz elektrolitu słabego (
![]() ) w funkcji
) w funkcji
![]() .
.
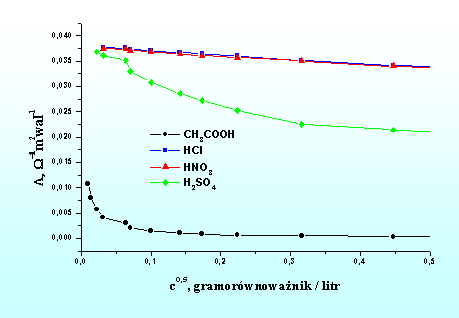
Rys.5.4. Wpływ stężenia elektrolitu na przewodnictwo równoważnikowe roztworu.
Przewodnictwo równoważnikowe elektrolitu zależy od jego stopnia dysocjacji a oraz ruchliwości jonów dodatnich u+ i ujemnych u-:
(5.21)
![]()
gdzie F jest stałą Faradaya, a n+ i n- są ilością jonów dodatnich i ujemnych powstałych wskutek dysocjacji elektrolitu.
Iloczyny
![]() i
i
![]() noszą
nazwę równoważnikowych przewodnictw jonowych. Przewodnictwo równoważnikowe elektrolitu jest więc
proporcjonalne do równoważnikowych przewodnictw jonowych oraz do stopnia
dysocjacji:
noszą
nazwę równoważnikowych przewodnictw jonowych. Przewodnictwo równoważnikowe elektrolitu jest więc
proporcjonalne do równoważnikowych przewodnictw jonowych oraz do stopnia
dysocjacji:
(5.22)
![]()
Zależność przewodnictwa równoważnikowego od stężenia elektrolitu jest skomplikowana. W najprostszym przybliżeniu można ją wyrazić równaniem Debye’a-Hückla-Onsagera:
(5.23)
![]()
Stałe
A i B są zależne od rodzaju rozpuszczalnika. Dla wody w 250C
wynoszą odpowiednio 60,20 i 0,229. Wartość
![]() , którą można uzyskać przez ekstrapolację równania (5.23) do stężenia
równego zeru (rozcieńczenia nieskończenie wielkiego
, którą można uzyskać przez ekstrapolację równania (5.23) do stężenia
równego zeru (rozcieńczenia nieskończenie wielkiego
![]() ), nosi nazwę granicznego przewodnictwa równoważnikowego. Jest
ono sumą granicznych równoważnikowych przewodnictw jonowych
), nosi nazwę granicznego przewodnictwa równoważnikowego. Jest
ono sumą granicznych równoważnikowych przewodnictw jonowych
![]() i
i
![]() :
:
Prawo niezależnej wędrówki jonó
(5.24)
![]()
Opisana zależność nosi nazwę prawa niezależnej wędrówki jonów Kohlrauscha.
Mówi nam ona, że w roztworze nieskończenie rozcieńczonym jony poruszają się swobodnie bez wzajemnego oddziaływania.
W
miarę rozcieńczania roztworu (
![]() ) stopień dysocjacji elektrolitu dąży do jedności. Ponieważ
dla roztworów tych
) stopień dysocjacji elektrolitu dąży do jedności. Ponieważ
dla roztworów tych
![]() , można stopień dysocjacji wyznaczyć przy pomocy pomiarów przewodnictwa
stosując zależność:
, można stopień dysocjacji wyznaczyć przy pomocy pomiarów przewodnictwa
stosując zależność:
(5.25)
![]()
czyli z ilorazu przewodnictwa równoważnikowego dla danego stężenia elektrolitu i granicznego przewodnictwa równoważnikowego.
Równanie (5.25) jest słuszne gdy założymy, że ruchliwość jonów jest niezależna od stężenia. Założenie to jest słuszne tylko dla roztworów rozcieńczonych. Z rysunku 5.3 wynika, że przy wysokich stężeniach przewodnictwo maleje wraz ze wzrostem koncentracji elektrolitu. W stężonych roztworach maleje bowiem „aktywność” jonów co jest spowodowane zmniejszeniem ich ruchliwości wskutek wzajemnego oddziaływania. Założenie niezależnej wędrówki jonów nie jest już słuszne.