Tlenki, wodorotlenki, kwasy i sole w naukach o Ziemi i środowisku
6. Sole
Ogólny wzór soli obojętnych to MnRm gdzie M oznacza kation metalu lub grupę amonową, a R to reszta kwasowa, n i m oznaczają współczynniki stechiometryczne odpowiadające ładunkowi kationu metalu (m) i ładunkowi reszty kwasowej (n).
Wodorosole, pochodzą od kwasów wielowodorowych, w których tylko część atomów wodoru jest zastępowana przez metal lub jon amonowy; można je przedstawić ogólnym wzorem: Mn(HkR)m, gdzie n,m,k – współczynniki stechiometryczne.
Hydroksosole, powstają z wodorotlenków wielohydroksylowych, i opisuje je wzór ogólny: Mn(OH)kRm, gdzie n,m,k – współczynniki stechiometryczne.
Sole uwodnione (hydraty) to sole o wzorze ogólnym a MnRm · b H2O, gdzie a oznacza liczbę moli soli, a b - liczbe moli wody.
Sole podwójne to związki chemiczne zawierające dwa rodzaje kationów i jeden rodzaj anionu lub jeden rodzaj kationu i dwa rodzaje anionów.
Obejrzyj film Sole podwójne.
Film: Sole podwójne*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.Podział
Jeden spójny podział soli jest trudny do wypracowania. Poniżej przedstawiono różne próby usystematyzowania tej wiedzy.
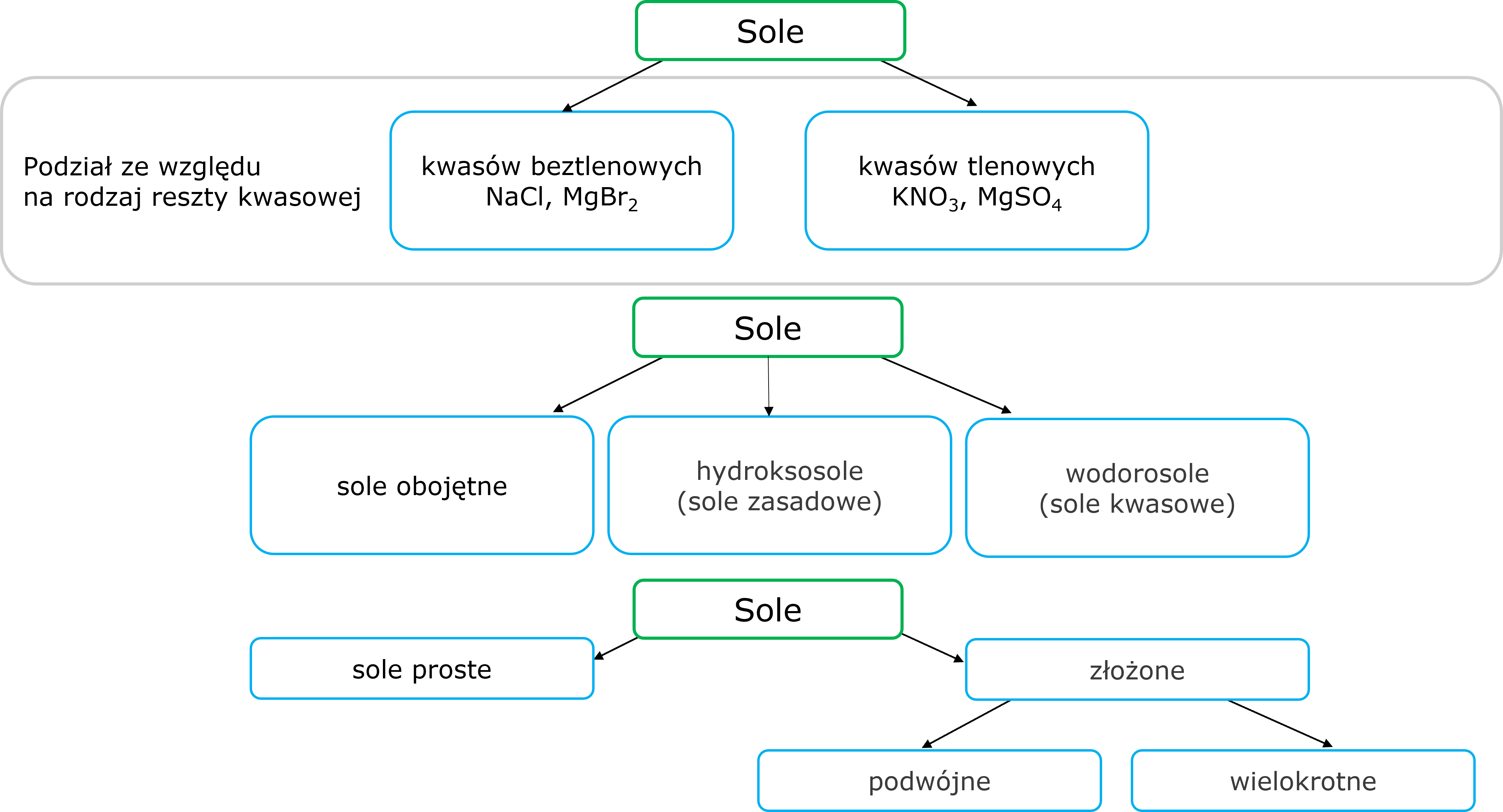
Grafika: oprac. Sylwia Zelek-Pogudz, licencja CC BY-SA 4.0 [na podst. Krzysztof M. Pazdro. Anna Rola-Noworyta, Chemia. Repetytorium dla przyszłych maturzystów i studentów. Warszawa : Oficyna Edukacyjna Krzysztof Pazdro, 2014.].
Wśród zaprezentowanych podziałów nie znalazła się nigdzie informacja o solach kompleksowych i hydratach. Należy to uzupełnić, zatem:
Sole kompleksowe to sole, które zwierają w swoim składzie kompleksowy kation i (lub) kompleksowy anion, np.: K4[Fe(CN)6]
Sole uwodnione (hydraty) to sole zawierające w sieci krystalicznej cząsteczki wody, czyli tzw. wodę hydratacyjną (krystalizacyjną), która może zostać uwolniona w procesie dehydratacji (odwodnienia) przebiegajacym zwykle podczas ogrzewania. W tym miejscu należy również zdefiniować proces hydratacji (akwatacji, uwodnienia), przekształacajacy substancje bezwodną w hydrat lub proces tworzenia akwakompleksów albo addycji wody do wiązań wielokrotnych.
Źródło: Oficyna Pazdro, Dehydratacja i hydratacja siarczanu(VI) miedzi(II): Doświadczenie 5.3, 2.10.2020 [dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=TWGX1T5jYRY.
Nazwy
- Nazwy soli prostych i złożonych
Nazwa soli prostej zawiera dwa wyrazy, pierwszy określający anion, a drugi – kation.
Nazwy soli złożonych składają się z tylu wyrazów, ile rodzajów jonów
zawiera sól, przy czym najpierw wymienia się aniony, a następnie kationy,
zachowując porządek alfabetyczny wymienianych jonów w obu grupach. Przedrostki
określające ilość danego rodzaju jonów nie wpływają na kolejność alfabetyczną.
- Nazewnictwo soli kwasów tlenowych
Pierwsza część nazwy soli pochodzi od nazwy kwasu i kończy się na -an np.: sól kwasu siarkowego(VI) to siarczan(VI), sól kwasu azotowego(V) to azotan(V). Druga część nazwy pochodzi od nazwy metalu. Jeśli metal posiada tylko jedną wartościowość to jej nie podajemy. Tak samo jeśli niemetal tworzy tylko jeden kwas to wartościowości niemetalu także nie podajemy. Przykładem może tu być kwas węglowy H2CO3 i jego sole węglany.
Przykłady soli:
MgSO4 - siarczan(VI) magnezu,KNO3 - azotan(V) potasu,
Na3PO4 - fosforan(V) sodu,
FeSO4 - siarczan(VI) żelaza(II),
Sole amonowe kwasów tlenowych
W przypadku soli amonowych zamiast nazwy metalu podajemy przyrostek "amonu".
NH4NO3 - azotan(V) amonu,(NH4)2SO4 - siarczan(VI) amonu.
- Nazewnictwo soli kwasów beztlenowych
Pierwsza część nazwy soli pochodzi od nazwy kwasu i kończy się na -ek. Na przykład sól kwasu chlorowodorowego to chlorek, sól kwasu bromowodorowego to bromek, sól kwasu siarkowodorowego to siarczek. Druga część nazwy pochodzi od nazwy metalu.
Przykłady soli:
NaCl - chlorek
sodu,
FeCl3
- chlorek żelaza(III).
Sole amonowe kwasów beztlenowych
W przypadku soli amonowych zamiast nazwy metalu podajemy przyrostek "amonu". Przykłady:
NH4Cl
- chlorek amonu,
NH4Br
- bromek amonu.
- Nazewnictwo wodorosoli
Nazwy wodorosoli zawierają liczbę atomów wodoru, jakie pozostały przy reszcie kwasowej:
K2HPO4
- wodorofosforan(V) potasu,
KH2PO4
- diwodorofosforan(V) potasu,
KHSO4
- wodorosiaczan(VI) potasu.
- Nazewnictwo hydroksosoli
Dla hydroksosoli podaje się liczbę grup wodorotlenkowych, które pozostały związane z metalem tworzącym sól:
Mg(OH)NO3
- azotan(V) wodorotlenek magnezu,
- Nazewnictwo hydratów
Wzory typu a MnRm · b H2O czyta się następująco, np.:
CaSO4 · 2 H2O – siarczan(VI) wapnia – woda
(1/2),
Na2CO3 · 10 H2O
– węglan sodu – woda (1/10),
2 CdSO4 · 8 H2O siarczan(VI) kadmu – woda (3/8).
Dla rozszerzenia i utrwalenia wiedzy obejrzyj film Nomenklatura i wzory hydratów.
Film: Nomenklatura i wzory hydratów*. Źródło: Patrycja Męcik, GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
Reakcje prowadzące do otrzymania soli
- Reakcje bezpośredniej syntezy z metalu i niemetalu (tylko sole kwasów beztlenowych)
2 Fe + 3 Cl2 → 2 FeCl3
Źródło: Oficyna Pazdro, Reakcja żelaza z chlorem: Doświadczenie 4.14, 2.10.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=6p_2ojrWOiM.
2 Al + 3 S → Al2S3
Źródło: Oficyna Pazdro, Synteza siarczku glinu Al2S3 z glinu i siarki: Doświadczenie 3.2 ZP i 5.2 ZR, 4.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=A8hnyIWwdYs.
- Reakcje kwasów z zasadami
Zapis cząsteczkowy: KOH + HCl → KCl + H2O
Zapis jonowy: K+ + OH- + H+ + Cl- → K+ + Cl- + H2O
Zapis jonowy skrócony: OH- + H+ → H2O
Źródło: Oficyna Pazdro, Reakcja zobojętniania: Doświadczenie 8.3, 26.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=2fl27LWrYo0.
Reakcje metali z kwasami
Zn + 2 HCl → ZnCl2 + H2
Źródło: Oficyna Pazdro, Reakcja cynku z kwasem solnym: Doświadczenie 6.10, 10.11.2017
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=jRdFkO0J0cI.
Reakcje tlenków metali z kwasami
Na2O + 2HCl → 2NaCl + H2O
- Reakcje tlenków niemetali z zasadami
SO3 + 2KOH → K2SO4 + H2O
- Reakcje tlenków metali z tlenkami niemetali
CaO + CO2 → CaCO3
- Reakcje soli z kwasami
CaCO3 + 2 HCl → CaCl2 + H2O · CO2↑
Źródło: Oficyna Pazdro, Reakcja węglanu wapnia z kwasem solnym: Doświadczenie 8.9, 26.03.2020[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=cIfkfiKDATk.
- Reakcje soli z zasadami
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2SO4
2 FeCl3 + 3 Ca(OH)2 → 2 Fe(OH)3↓ + 3 CaCl2
(NH4)2SO4 + 2 NaOH → Na2SO4 + 2 NH3↑ + 2 H2O
Źródło: Oficyna Pazdro, Rozkład soli amonowej pod wpływem zasady: Doświadczenie 8.11, 26.03.2020
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=hqJSUgH413U.
- Reakcje soli z solami
AgNO3 + NaCl → AgCl↓ + NaNO3
Pb(NO3)2 + 2 KI → PbI2↓ + 2 KNO3
Źródło: Oficyna Pazdro, Strącanie osadów substancji trudno rozpuszczalnych: Doświadczenie 8.4, 26.03.2020
[dostęp: 22.02.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=REEtHAkUKoA.
Budowa i właściwości fizyczne
Sole to najszersza grupa spośród omawianych. Wspólną ich cechą jest jednak stan skupienia, przede wszystkim są to ciałą stałe. Natomiast pod wzgledem innych właściwości fizycznych, np. takich jak ropuszczalność czy barwa, są bardzo zróżnicowane. Warto podkreślić, iż sole dobrze rozpuszczalne w wodzie, w wodzie dysocjują z utworzeniem kationów metalu i anionów reszty kwasowej, i przewodzą prąd elektryczny.
KCl → K+ + Cl-
Poniżej zamieszczono tablice rozpuszczalności przykładowych soli w wodzie.
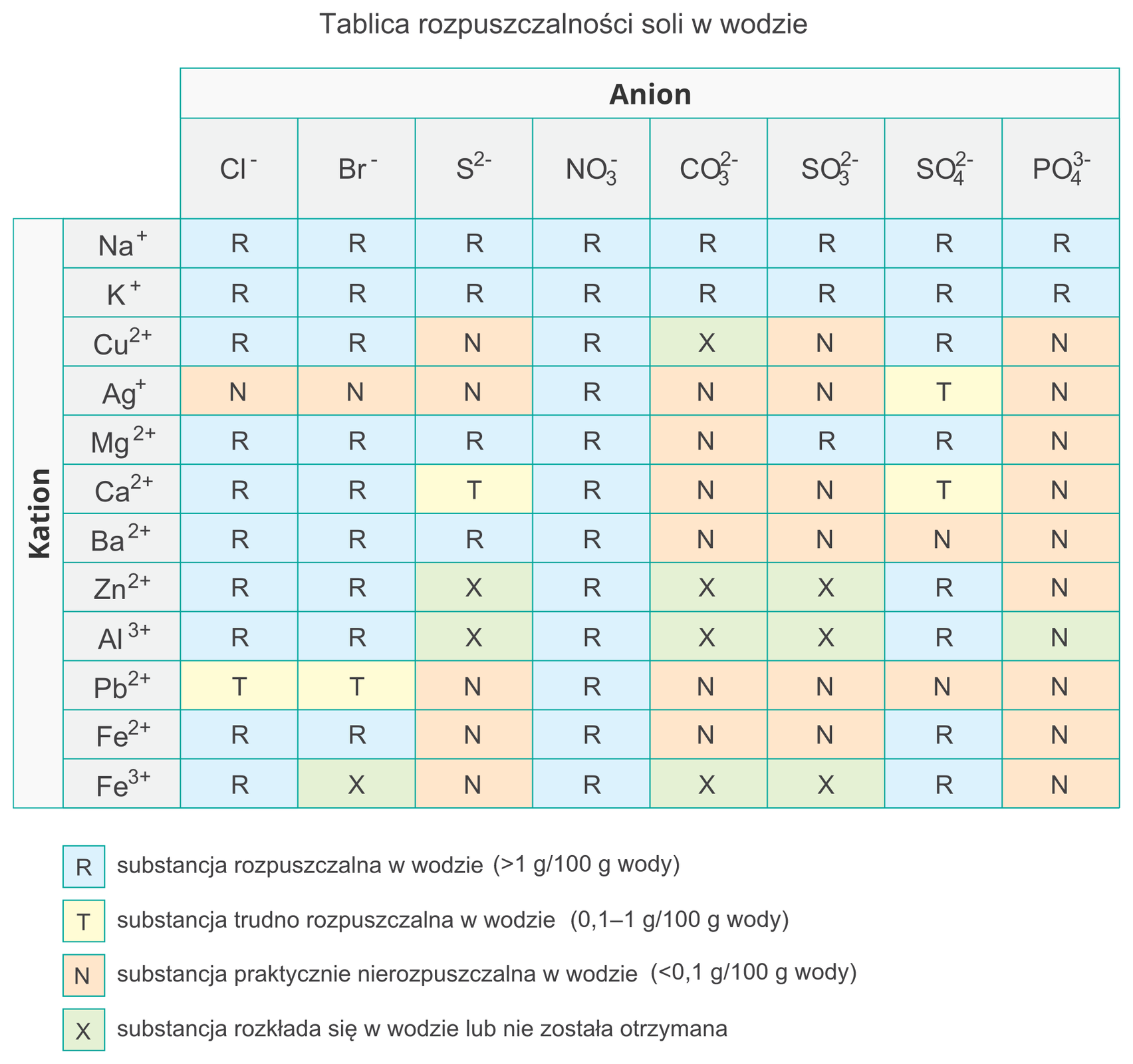
Grafika: Tablica rozpuszczalności soli w wodzie*. Źródło: epodreczniki.pl, licencja: CC BY-SA 3.0.
Właściwości chemiczne
- Rozkład termiczny lub fotochemiczny
NH4Cl → NH3↑ + HCl
NH4SO4 → NH3↑ + H2SO4
Źródło: Oficyna Pazdro, Rozkład termiczny chlorku amonu: Doświadczenie 8.10, 26.03.2020
[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=3BVYpNEX1Yc.NaHCO3 → NaCO3 + H2O + CO2↑
- Wymiana podwójna
- stracanie substancji słaborozpuszczalnej: AgNO3 + KCl → AgCl↓+ KNO3
- tworzenie słabego elektrolitu: Na2CO3 + 2 HCl → 2 NaCl + H2O · CO2
- Wymiana pojedyncza
Zn + CuSO4 → ZnSO4 + Cu
Źródło: Oficyna Pazdro, Reakcja cynku z siarczanem(VI) miedzi(II): Doświadczenie 3.1. ZP i 2.1. ZR, 1.10.2020[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=h9rX6GVpxts.
- Hydroliza
Hydroliza soli – reakcja chemiczna zachodząca zaraz po dysocjacji elektrolitycznej soli w trakcie rozpuszczania ich w wodzie. Reakcja ta powoduje, że roztwory wielu soli nie mają obojętnego pH lecz są bardziej lub mniej kwaśne lub zasadowe
Hydrolizie ulegają sole:
- mocnych kwasów i słabych zasad
- słabych kwasów i mocnych zasad
- słabych kwasów i słabych zasad
Hydrolizie nie ulegają sole mocnych kwasów i mocnych zasad
Źródło: Oficyna Pazdro, Badanie odczynu wodnych roztworów wybranych soli: Doświadczenie 2.7. ZP i 1.9. ZR, 1.10.2020[dostęp: 1.03.2023]. Dostępne w YouTube: https://www.youtube.com/watch?v=QUu9226qph0.
Krok
1. Ustalić jaka to sól
Czy jest to sól mocnego czy słabego kwasu i słabej lub mocnej zasady?

Krok 2. Zapisujemy równanie reakcji soli z wodą
NaHCO3 – sól słabego kwasu i mocnej zasady
NaHCO3 + H2O → NaOH + H2O · CO2 hydroliza anionowa
Na+ +HCO3- + H+ + OH- → Na+ + OH- + H2O · CO2 pH>7
NH4Cl – sól mocnego kwasu i słabej zasady
NH4Cl + H2O → NH3 · H2O + HCl hydroliza kationowa
NH4+ + Cl- + H+ + OH- → NH3 · H2O + H+
+ Cl- pH<7
NaCl – sól mocnego kwasu i mocnej zasady – nie hydrolizuje
NH4HCO3 – sól słabego kwasu i mocnej zasady
NH4HCO3 + H2O → NH3·H2O + H2O · CO2 hydroliza kationowo-anionowa
NH4+ + HCO3- + H+ + OH- → NH3 · H2O + H2O · CO2
O odczynie decyduje różnica mocy elektrolitów (można ją ustalić na podstawie wartości stałych dysocjacji.
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot

