Jak Geolog może wykorzystać wiedzę o jądrze atomowym i przemianach jądrowych?
1. Składniki atomu
Oglądnij film przedstawiający współczesną teorię budowy atomu, wprowadzi Cię on w zagadnienia poruszane w tym temacie.
Film: Współczesny opis budowy atomu*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
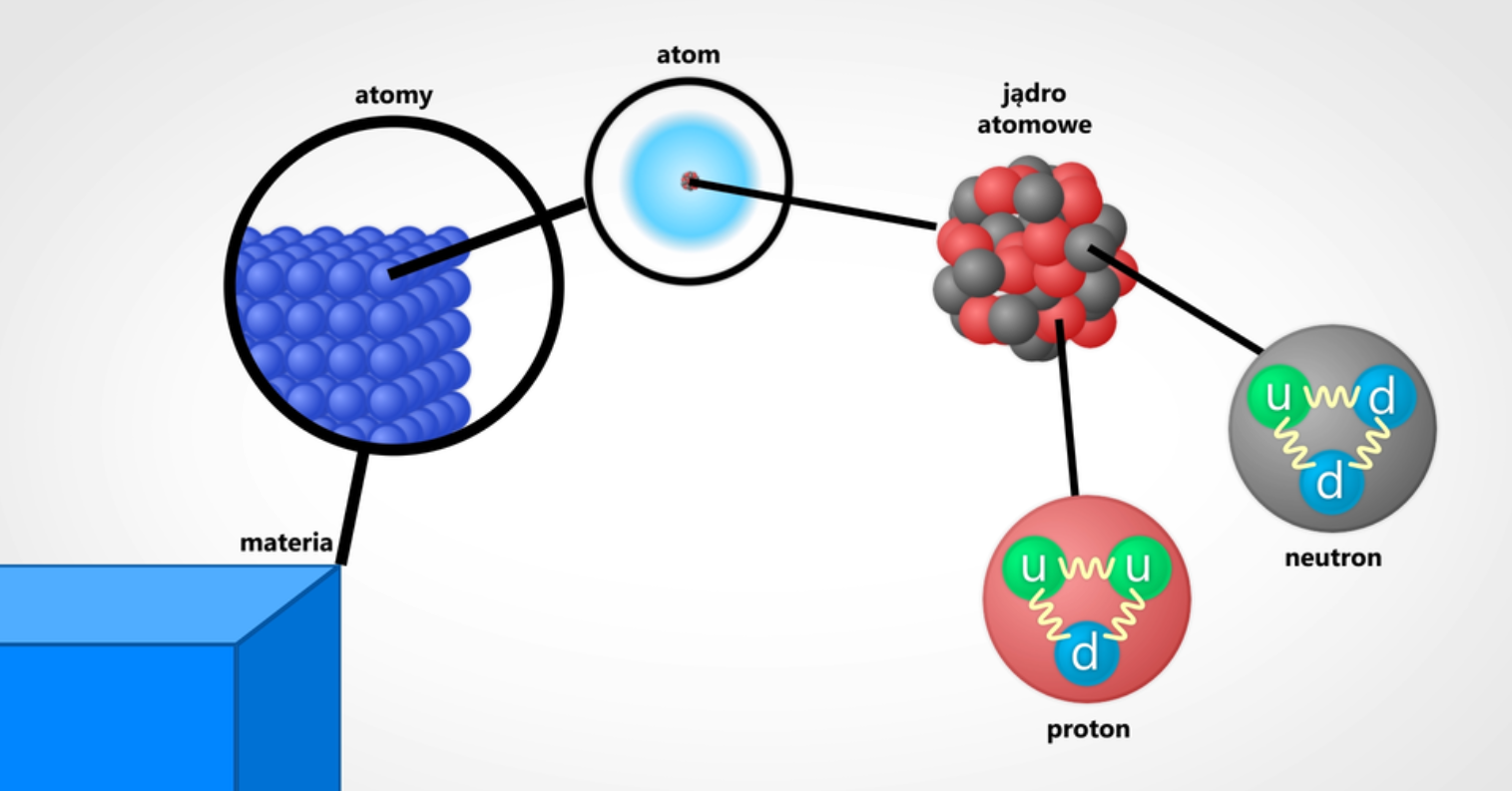
Atomy składają się z trzech rodzajów cząstek subatomowych, są to
protony, neutrony i elektrony. Protony i neutrony są łącznie nazywane
nukleonami.
Grafika: Model budowy atomu*. Źródło: GroMar Sp. z o.o., licencja: CC BY-SA 3.0.
W geometrycznym środku atomu znajduje się dodatnio naładowane jądro
atomowe zbudowane z protonów i neutronów. Jądro atomowe jest bardzo małe w porównaniu z rozmiarami całego atomu (rozmiary atomu są rzędu 10-10
m ) i ma wymiary rzędu 10-14–10-15 m, jest przy tym bardzo
ciężkie, jego masa stanowi 99,99% masy atomu.
Proton i neutron posiadają niemal jednakową masę, około 1u. Proton ma ładunek dodatni, a neutron jest elektrycznie obojętny.
Liczba protonów w jądrze to liczba atomowa oznaczana symbolem Z, a liczba nukleonów (suma ilości protonów i neutronów) to liczba masowa A. Informacje o liczbie składników jądra możemy zapisać w postaci indeksów po lewej stronie symbolu chemicznego danego pierwiastka:

Grafika: Opis budowy atomu za pomocą symboli*. Źródło: Krzysztof Jaworski, OpenClips, dostępny w internecie: http://pixabay.com, licencja: CC BY-SA 3.0.
Liczba
atomowa Z jest równa liczbie protonów w jądrze, liczbie elektronów w atomie (dlatego
atom jest elektrycznie obojętny), i stanowi również liczbę porządkową w
układzie okresowym pierwiastków chemicznych.
W
przestrzeni wokół jądra zwanej chmurą elektronową znajdują się elektrony (promień elektronu jest rzędu 10-22 m). Masa elektronu jest rzędu 1/1823 u. Łączna masa wszystkich elektronów w atomie nie przekracza 0.1% masy atomu. Ładunek elektronu w atomie (i w innych
drobinach) nie jest zlokalizowany, lecz rozproszony nierównomiernie. Miarą tego rozproszenia
jest tzw. gęstość elektronowa czyli stosunek ładunku znajdującego się w
określonej objętości do tej objętości. Największa gęstość elektronowa jest tuż
przy jądrze i maleje wykładniczo z odległością od jądra atomowego, a w
odległości stu-kilkudziesięciu pm staje się zaniedbywanie mała, jednak
niezerowa. Nie można określić toru po jakim porusza się elektron, wiadomo
jedynie, że niektóre elektrony poruszają się bliżej jądra, a inne dalej.
Ujemny ładunek elektronu i dodatni ładunek protonu mają tę samą wartość bezwzględną (różnią się tylko znakami), zatem wartość ładunku elektronu została przyjęta za -1, a protonu za +1.
| Jądro atomowe | Chmura elektronowa | |
|---|---|---|
| Przybliżone rozmiary | 10-14 m | 10-10 m |
| Ładunek | dodatni | ujemny |
Elementy składowe Cząstki subatomowe |
protony (ładunek dodatni) i neutrony (elektrycznie neutralne) |
elektrony (ładunek ujemny) |
| Przybliżona masa pojedynczej cząstki | 1.7·10-27 kg (około 1800 razy masa elektronu) proton – masa 1,007276470 u neutron – masa 1,008664904 u |
9·10-31 kg elektron – masa 1/1823 u = 0,0005485799 u |
| Relatywna liczba cząstek | w większości jąder nieco większa liczba neutronów niż protonów | liczba elektronów jest równa liczbie atomowej Z, równa liczbie protonów |
Przybliżona gęstość materii [kg·dm-3 = g·cm-3] |
1012 kg·dm-3 |
1 kg·dm-3 |
Między jądrem i elektronami działają siły przyciągania elektrostatycznego. Z kolei elektrony odpychają się jak wszystkie ładunki jednoimienne. Również między protonami działają siły odpychania elektrostatycznego. Jądro utrzymują w całości inne, znacznie większe siły przyciągające, zwane siłami jądrowymi lub oddziaływaniami silnymi. W wyniku działania wielu różnych sił atom jest trwały, a elektrony nie spadają na jądro ani się od niego nie oddalają.
Jądro atomowe determinuje właściwości fizyczne pierwiastka, natomiast struktura elektronowa decyduje o właściwościach chemicznych i niektórych właściwościach fizycznych.
_________________
* Wykorzystano grafiki zamieszczone na Zintegrowanej Platformie Edukacyjnej.

Ikona (źródło): Reshot