2.3.1.3 Kryształy molekularne
Kryształy
tego rodzaju zbudowane są z cząsteczek. Oddziaływania pomiędzy cząsteczkami
mogą mieć różny charakter. W krysztale lodu cząsteczki
![]() związane są wiązaniami
wodorowymi (II.1.4) (rys.4.05).
związane są wiązaniami
wodorowymi (II.1.4) (rys.4.05).
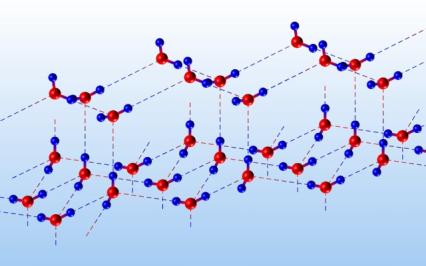
Rys.4.05. Struktura lodu, linią przerywaną zaznaczono wiązanie wodorowe pomiędzy atomem tlenu a atomem wodoru.
W
krysztale
![]() (suchy lód) cząsteczki łączą
się poprzez siły Van der Waalsa
(II.1).
(suchy lód) cząsteczki łączą
się poprzez siły Van der Waalsa
(II.1).
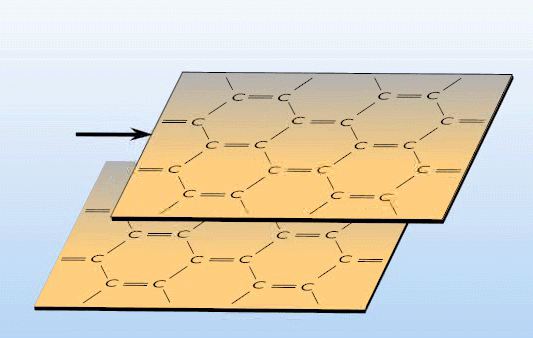
Często mamy w kryształach molekularnych do czynienia z wieloma typami wiązań. Przykładem może być grafit (rys.4.06).
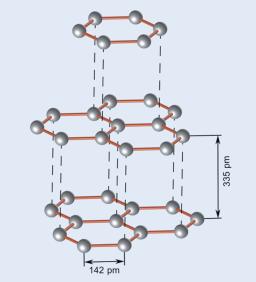
Rys.4.06. Sieć krystalograficzna grafitu.
Posiada
on budowę warstwową. W obrębie warstwy atomy węgla tworzą silne wiązania
atomowe, podczas gdy poszczególne
warstwy powiązane są słabymi siłami van der Waalsa. Grafit tworzy więc
nieregularną komórkę heksagonalną, gdzie
![]() . Tego rodzaju budowa powoduje izotropię
własności mechanicznych. Warstwy są słabo związane i mogą ulegać poślizgowi
pod wpływem siły przyłożonej wzdłuż kierunków x, y (rys.
4.07). Atomy węgla połączone w obrębie warstwy trzema wiązaniami
atomowymi posiadają „wolny” nie sparowany elektron co daje grafitowi
przewodnictwo elektronowe.
. Tego rodzaju budowa powoduje izotropię
własności mechanicznych. Warstwy są słabo związane i mogą ulegać poślizgowi
pod wpływem siły przyłożonej wzdłuż kierunków x, y (rys.
4.07). Atomy węgla połączone w obrębie warstwy trzema wiązaniami
atomowymi posiadają „wolny” nie sparowany elektron co daje grafitowi
przewodnictwo elektronowe.
Kliknij na rysunek aby zobaczyć animacje.
Rys.4.07. Poślizg płaszczyzn grafitu w wyniku przyłożonej siły.