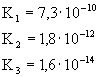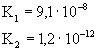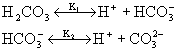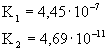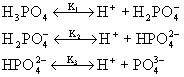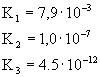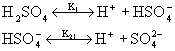5. Równowagi jonowe w roztworach
5.1 Dysocjacja elektrolityczna
Dysocjacją elektrolityczną nazywamy rozpad substancji na jony pod wpływem rozpuszczalnika. W wyniku tego procesu powstaje roztwór przewodzący prąd. Substancje ulegające dysocjacji elektrolitycznej nazywamy elektrolitami.
Przewodnictwo elektrolitu jest przewodnictwem jonowym związanym z ruchem kationów i anionów w polu elektrycznym.
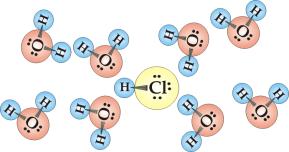
Rys.5.1
przedstawia proces dysocjacji cząsteczki chlorowodoru w rozpuszczalniku
polarnym jakim jest woda. W cząsteczce chlorowodoru atom wodoru związany
jest z chlorem silnie spolaryzowanym wiązaniem
atomowym (I.3.2.2). Wprowadzenie chlorowodoru do wody prowadzi do orientacji
polarnych cząsteczek
![]() wokół cząsteczek HCl
.Następuje rozerwanie wiązania wodór-chlor i utworzenie uwodnionych jonów
wokół cząsteczek HCl
.Następuje rozerwanie wiązania wodór-chlor i utworzenie uwodnionych jonów
![]() i
i
![]() . Powstaje w ten sposób wodny roztwór kwasu solnego.
. Powstaje w ten sposób wodny roztwór kwasu solnego.
![]()
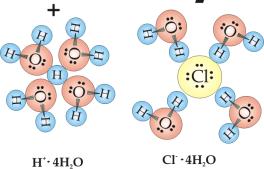
Rys.5.1. Dysocjacja chlorowodoru w wodzie.
Proces dysocjacji chlorowodoru możemy zapisać w postaci równania chemicznego:
(5.01)
![]()
Zdolność
substancji do dysocjacji zależy od jej polarności oraz polarności
rozpuszczalnika. Im silniej jest spolaryzowana cząsteczka tym łatwiej ulega ona rozpadowi na jony w rozpuszczalniku polarnym.
Chlorowodór jest cząsteczką bardzo silnie spolaryzowaną. W wodzie
praktycznie całkowicie rozpada się na jony i stąd w równaniu (5.01)
dysocjację HCl przedstawiono jako reakcję nieodwracalną, zachodzącą
tylko w jednym kierunku, w kierunku tworzenia jonów
![]() i
i
![]() .
.
Nie wszystkie substancje rozpadają się w jednakowym stopniu na jony. Niektóre cząsteczki o silnych, słabo spolaryzowanych wiązaniach atomowych w ogóle nie ulegają dysocjacji. Nazywamy je nieelektrolitami. Przykładem mogą być cząsteczki cukru.
Część cząsteczek rozpada się częściowo na jony i proces ten można ogólnie opisać równowagą chemiczną:
(5.02)
![]()
Równowaga opisaną reakcją (5.02) jest równowagą dysocjacji. Stała równowagi (IV.2.2) tej reakcji:
Stała dysocjacji
(5.03)
![]()
nosi
nazwę stałej dysocjacji. Im większa
wartość
![]() tym bardziej substancja jest
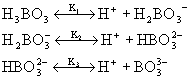
zdysocjowana w roztworze. W tablicy 5.1. podano przykłady równowag
jonowych oraz stałych dysocjacji elektrolitów w roztworach wodnych.
tym bardziej substancja jest
zdysocjowana w roztworze. W tablicy 5.1. podano przykłady równowag
jonowych oraz stałych dysocjacji elektrolitów w roztworach wodnych.
Tablica 5.1
Stała dysocjacji i stopień dysocjacji dla wybranych elektrolitów |
|||
Substancja |
Reakcja dysocjacji |
Stała dysocjacjiK
|
Stopień dysocjacjia |
|
|
|
|
0,0001 dla 0,03m (pierwszy
stopień dysocjacji) |
|
|
|
|
0,0007 dla 0,05M (pierwszy stopień dysocjacji) |
|
|
|
|
0,021 dla 0,02m 0,017 dla 0,05m (pierwszy
stopień dysocjacji) |
|
|
|
|
0,013 dla 0,1M 0,004 dla 1,0M |
|
|
|
|
0,013 dla 0,1M 0,004 dla 1,0M |
|
|
|
|
0,27 dla 0,03M 0,17 dla 0,2M |
|
|
|
|
0,58 dla 0,05M 0,01 dla stężonego kwasu |
|
|
|
|
0,09 dla 0,0075M |
Istnieje jeszcze jeden sposób wyrażania zdolności substancji do dysocjacji w danym rozpuszczalniku. Jest nim stopień dysocjacji.
Stopniem dysocjacji nazywamy stosunek ilości cząsteczek substancji które rozpadły się na jony do całkowitej (rozpuszczonej) ilości cząsteczek:
(5.04)
![]()
Ilość cząsteczek w równaniu (5.04) można zastąpić ilością
moli n:
(5.05)
![]()
Stopień dysocjacji jest liczbą
bezwymiarową mieszczącą się w przedziale
![]() . Można go również wyrazić w procentach:
. Można go również wyrazić w procentach:
(5.06)
![]()
Elektrolity
mocne i słabe
Elektrolity
o wartości
![]() a zbliżonej do jedności nazywamy elektrolitami mocnymi. Elektrolity słabe
to elektrolity których a jest bardzo małe, na ogół mniejsze od 0,1.
a zbliżonej do jedności nazywamy elektrolitami mocnymi. Elektrolity słabe
to elektrolity których a jest bardzo małe, na ogół mniejsze od 0,1.